
 2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( )
2C的反应来说,以下化学反应速率的表示中,反应速率最快的是 ( ) 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源:不详 题型:填空题

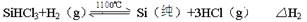
| 物质 | BCl3 | PCl3 | SiCl4 | AsCl3 | AlCl3 | SiHCl3 |
| 沸点 | 12.1 | 73.5 | 57.0 | 129.4 | 180(升华) | 31.2 |
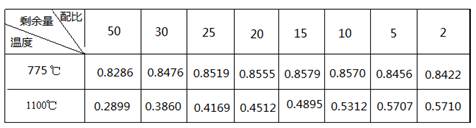
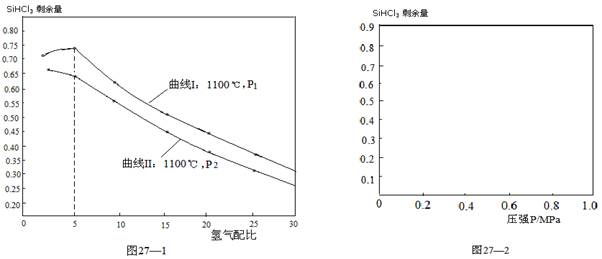
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
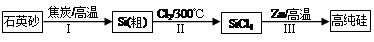
 Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0 Si(S)+2ZnCl2(g) △H2<0
Si(S)+2ZnCl2(g) △H2<0 Si(S)+2ZnCl2(g) △H3<0
Si(S)+2ZnCl2(g) △H3<0查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:
4NO(g)+6HO(g) △H=-Q kJ· mol-1(Q>0),容器内部分物质的物质的量浓度如下表:| 时间/浓度 | c(NH3)( mol·L-1) | c(O2)( mol·L-1) | c(NO)( mol·L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )
2C(g)+2D(g),在不同条件下的化学反应速率,其中反应速率最快的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( )
Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是 ( ) 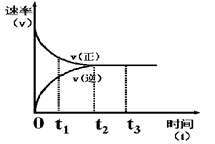
| A.t1时,正反应速率大于逆反应速率 |
| B.t2时,达到该条件下的最大反应限度 |
| C.t2- t3,反应不再发生,各物质的浓度相等 |
| D.t3后,该反应的反应限度有可能被外界条件改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )。
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )。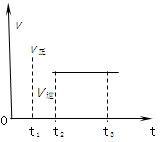
| A.t1时,只有正方向反应 |
| B.t2- t3,各物质的浓度不再发生变化 |
| C.t2- t3,反应不再发生 |
| D.t2时,反应未到达限度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 HOI(aq) △H2
HOI(aq) △H2 I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3 I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。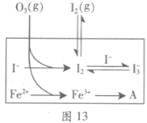
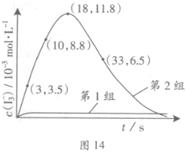
| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+ I- | 5.2 | 11.0 |
| 第2组 | O3+ I-+ Fe2+ | 5.2 | 4.1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是
pC(g)+qD(g)的v-t图象如下右图,如若其它条件不变,只是在反应前加入合适的催化剂,则其v-t图象如下右图:①a1>a2②a1<a2③b1>b2④b1<b2 ⑤t1>t2 ⑥t1=t2 ⑦两图中阴影部分面积相等 ⑧右图中阴影部分面积更大,以上说法中正确的是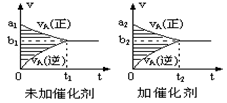
| A.②③⑤⑧ | B.①④⑥⑧ | C.②④⑤⑦ | D.①③⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com