

分析 废旧玻璃粉末用氢氧化钠溶液溶解,二氧化硅能与氢氧化钠溶液,而Fe2O3、CeO2、FeO不反应,过滤分离,滤液A中主要为偏铝酸钠,滤渣A为Fe2O3、CeO2、FeO等,再用硫酸溶解滤渣,Fe2O3、FeO反应,而CeO2不反应,过滤得到滤液B中主要含有硫酸铁、硫酸亚铁,滤渣B为CeO2,洗涤除去附着的Fe3+、Fe2+等,滤渣B中加入硫酸、过氧化氢,二酸性条件下,Ce4+有较强氧化性,得到Ce3+的稀溶液,加入HT进行萃取,再进行分液,有机层中加入反萃取剂得到Ce3+的浓溶液,根据平衡移动原理,反萃取剂应为酸,加入碱,然后氧化得到Ce(OH)4.
解答 解:废旧玻璃粉末用氢氧化钠溶液溶解,二氧化硅能与氢氧化钠溶液,而Fe2O3、CeO2、FeO不反应,过滤分离,滤液A中主要为偏铝酸钠,滤渣A为Fe2O3、CeO2、FeO等,再用硫酸溶解滤渣,Fe2O3、FeO反应,而CeO2不反应,过滤得到滤液B中主要含有硫酸铁、硫酸亚铁,滤渣B为CeO2,洗涤除去附着的Fe3+、Fe2+等,滤渣B中加入硫酸、过氧化氢,酸性条件下,Ce4+有较强氧化性,过氧化氢作还原剂,将CeO2转化为Ce3+的稀溶液,加入HT进行萃取,再进行分液,有机层中加入反萃取剂得到Ce3+的浓溶液,根据平衡移动原理,反萃取剂应为酸,加入碱,然后氧化得到Ce(OH)4.
(1)反应I的离子方程式是:SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2+2OH-=SiO32-+H2O;
(2)操作Ⅱ中的“洗涤”的目的主要是为了除去Fe3+、Fe2+等,洗涤沉淀的操作方法是:过滤器加蒸馏水至浸没沉淀,待水自然流下,重复操作2-3次,直至洗涤干净即可,
故答案为:Fe3+、Fe2+;向过滤器加蒸馏水至浸没沉淀,待水自然流下,重复操作2-3次,直至洗涤干净即可;
(3)反应Ⅲ中H2O2的作用是:做还原剂,将CeO2转化为Ce3+,
故答案为:做还原剂,将CeO2转化为Ce3+;
(4)操作Ⅲ是从将铈离子从水溶液中萃取出来,并进行与水层进行分离,进行的操作为:萃取、分液,
故答案为:萃取、分液;
(5)加入CeT3 (有机层)加入反萃取剂以获得较纯的含Ce3+的水溶液,根据平衡移动原理,反萃取剂应为酸,可以为硫酸,
故答案为:硫酸.
点评 本题考查物质准备工艺流程,关键是对工艺流程图的理解,熟练掌握元素化合物知识,侧重考查学生分析能力、信息获取与知识迁移运用能力,理解掌握物质分离提纯常用方法,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 第17.18列元素都是非金属元素 | |
| B. | 第14列元素形成的化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中的SO2溶于水,最终形成酸雨 | |
| B. | 汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物 | |
| C. | 工业废水任意排放是造成酸雨的主要原因 | |
| D. | 为了减少酸雨的形成,必须减少SO2的排放量,对燃料脱硫处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
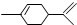 ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )| A. | 分子式为C10H16 | |
| B. | 常温下呈液态难溶于水 | |
| C. | 所有原子可能共平面 | |
| D. | 与过量溴的CCl4 溶液反应后产物(如图)为: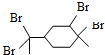 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验氯乙烷中的氯元素,加碱溶液加热后,用稀硫酸酸化后,再检验 | |
| B. | 鉴别溶液中是否有SO42-,用盐酸酸化 | |
| C. | 为抑制Fe2+的水解,用稀硝酸酸化 | |
| D. | 为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和SO2 | B. | 甲醛和苯等有机物 | ||
| C. | SO2和NO2 | D. | O3和Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com