
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
分析 铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol•L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
第③组实验中溶解金属为3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu或铜与铁的混合物,根据铁离子的物质的量可计算得混合物中m(Fe):m(Cu)=0.84g:0.96g=7:8;
故第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2,据此进行解答.
解答 解:铁的还原性强于铜,所以Fe3+先和铁发生反应:Fe+2Fe3+=3Fe2+,反应后Fe3+有剩余,再与铜发生反应:Cu+2Fe3+=2Fe2++Cu2+,所以剩余的固体是铜或铁和铜,
从第②组数据,可以得出FeCl3溶液全部参与反应,40mL 1mol•L-1FeCl3溶液能溶解金属质量1.80g-0.64g=1.16g,大于第①组溶解的金属质量,故第①组金属完全反应、FeCl3有剩余;
第②组实验中FeCl3溶液全部参与反应,其物质的量为=0.04L×1mol/L=0.04mol,假设只发生Fe+2Fe3+=3Fe2+,参加反应Fe的物质的量为0.02mol,则溶解的Fe的质量为0.02mol×56g/mol=1.12g<1.16g,所以同时也有一部分Cu溶解,所以剩余的固体全部为Cu;
第③组实验中溶解金属为3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu或铜与铁的混合物,根据铁离子的物质的量可计算得混合物中m(Fe):m(Cu)=0.84g:0.96g=7:8;
故第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2;
(1)第④组实验中,剩余固体为Fe、Cu,溶液中溶质为FeCl2,则溶液中存在c(Fe2+)=$\frac{1}{2}$c(Cl-)=$\frac{3}{2}$c(FeCl3)=$\frac{3}{2}$×1mol/L=1.5 mol/L,
故答案为:1.5;
(2)第③组实验中溶解金属为:3.60g-2.48g=1.12g,混合物中Fe恰好完全反应、Cu不反应,剩余2.48g为Cu或铜与铁的混合物,根据铁离子的物质的量可计算得混合物中m(Fe):m(Cu)=0.84g:0.96g=7:8,
故答案为:7:8.
点评 本题考查混合物的计算,题目难度中等,明确物质反应先后顺序及各组剩余固体成分是解本题关键,再结合转移电子守恒、原子守恒进行解答,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.64g | B. | 1.28g | C. | 2.56g | D. | 5.12g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和反应是吸热反应 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 放热反应不用加热也一定能发生 | |
| D. | 反应是放热还是吸热可以看反应物和生成物所具有的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 酸性氧化物 | 非电解质 | |
| 属于该类的物质 | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
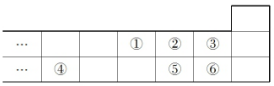
| A. | 最高价氧化物对应水化物的酸性:⑥>⑤ | |
| B. | 气态氢化物的稳定性:⑤>② | |
| C. | 元素的简单离子半径大小:④>⑤>② | |
| D. | 元素的最高正化合价:③=⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ag+ | B. | Ca2+ | C. | CO${\;}_{3}^{2-}$ | D. | NO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com