
| A. | H+、A1O2-、Na+、Cl- | B. | 强碱性溶液:Na+、HCO3-、SO42- | ||
| C. | Fe2+、Fe3+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
科目:高中化学 来源: 题型:选择题
| A. | Cu+2H+═Cu2++H2↑ | B. | Na+H2O═Na++2OH-+H2↑ | ||
| C. | NH4++OH-═NH4OH | D. | CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O=2NaOH+H2↑ | |
| B. | SO2+2H2S=3S+2H2O | |
| C. | N2+3H2=2NH3 | |
| D. | Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
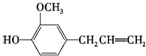 丁子香酚可用作杀虫剂和防腐剂,其结构简式如图:
丁子香酚可用作杀虫剂和防腐剂,其结构简式如图: (任意2种)..
(任意2种)..查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  $→_{95℃}^{62%H_{2}SO_{4}}$ CH3CH=CHCH3+H2O $→_{95℃}^{62%H_{2}SO_{4}}$ CH3CH=CHCH3+H2O | |
| B. | CH3CH2Br+NaOH→CH3CH2OH+NaBr | |
| C. | CH3COOH+CH3OH $?_{加热}^{催化剂}$?CH3COOCH3+H2O | |
| D. | RCOOCH3+H2O $\stackrel{H_{2}SO_{4}}{?}$ RCOOH+CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的组成不可能是ABC3或A3BC4 | |
| B. | M的水溶液不可能呈中性 | |
| C. | 用石墨电极电解M的水溶液时,pH不可能减小 | |
| D. | M不可能是离子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 混合物 | 需加入的试剂 | 分离方法 |
| ①苯(苯酚) | ||
| ②乙烷(乙烯) | ||
| ③乙醇(水) | ||
| ④乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;W单质晶体中微粒堆积方式为面心立方堆积,若W单质晶体中一个晶胞的边长为a cm,则W单质晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g/cm3(写出含a的表 达式,用NA表示阿伏加德罗常数的值)g.cm-3.
;W单质晶体中微粒堆积方式为面心立方堆积,若W单质晶体中一个晶胞的边长为a cm,则W单质晶体的密度为$\frac{256}{{a}^{3}{N}_{A}}$g/cm3(写出含a的表 达式,用NA表示阿伏加德罗常数的值)g.cm-3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com