

·ÖĪö ÓŠA£¬B£¬C£¬D£¬E£¬F£¬GĘßÖÖĪļÖŹ£¬A£¬CĪŖ³£¼ūµ„ÖŹ£¬CĪŖ»ĘĀĢÉ«ĘųĢ壬ŌņCŹĒCl2£»EŹĒŅ»ÖÖČõĖįĒŅÓŠĘÆ°××÷ÓĆ£¬ŌņEŹĒHClO£¬FŹĒŅ»ÖÖĒæĖį£¬Cl2ŗĶH2O·“Ӧɜ³ÉHClŗĶHClO£¬ĒŅŃĪĖįŹĒĒæĖį£¬ŌņBĪŖH2O£»
GµÄŃęÉ«·“Ó¦ĪŖ»ĘÉ«£¬ŌņGÖŠŗ¬ÓŠNaŌŖĖŲ£¬AŹĒµ„ÖŹ£¬øł¾ŻŌŖĖŲŹŲŗćÖŖ£¬AĪŖNa£¬DĪŖNaOH£¬GĪŖNaClO£¬NaClOŗĶHCl·“Ӧɜ³ÉHClO£¬¾Ż“Ė·ÖĪö½ā“š£®
½ā“š ½ā£ŗÓŠA£¬B£¬C£¬D£¬E£¬F£¬GĘßÖÖĪļÖŹ£¬A£¬CĪŖ³£¼ūµ„ÖŹ£¬CĪŖ»ĘĀĢÉ«ĘųĢ壬ŌņCŹĒCl2£»EŹĒŅ»ÖÖČõĖįĒŅÓŠĘÆ°××÷ÓĆ£¬ŌņEŹĒHClO£¬FŹĒŅ»ÖÖĒæĖį£¬Cl2ŗĶH2O·“Ӧɜ³ÉHClŗĶHClO£¬ĒŅŃĪĖįŹĒĒæĖį£¬ŌņBĪŖH2O£»GµÄŃęÉ«·“Ó¦ĪŖ»ĘÉ«£¬ŌņGÖŠŗ¬ÓŠNaŌŖĖŲ£¬AŹĒµ„ÖŹ£¬øł¾ŻŌŖĖŲŹŲŗćÖŖ£¬AĪŖNa£¬DĪŖNaOH£¬GĪŖNaClO£¬NaClOŗĶHCl·“Ӧɜ³ÉHClO£¬
£Ø1£©A”¢B”¢DĆū³Ę·Ö±šŹĒÄĘ”¢Ė®”¢ĒāŃõ»ÆÄĘ£¬¹Ź“š°øĪŖ£ŗÄĘ£»Ė®£»ĒāŃõ»ÆÄĘ£»
£Ø2£©BŹĒĖ®”¢CŹĒĀČĘų£¬BÓėC·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒCl2+H2O=HCl+HClO£¬øĆ·“Ó¦ÖŠĀČĘų¼ČŹĒŃõ»Æ¼ĮÓÖŹĒ»¹Ō¼Į£¬1mol CĶźČ«·“Ó¦£¬×ŖŅʵē×Ó1mol£¬
¹Ź“š°øĪŖ£ŗCl2+H2O=HCl+HClO£»1£»
£Ø3£©FŹĒŃĪĖį”¢GŹĒ“ĪĀČĖįÄĘ£¬FÓėG·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒHCl+NaClO=HClO+NaCl£¬¹Ź“š°øĪŖ£ŗHCl+NaClO=HClO+NaCl£»
£Ø4£©FŹĒHCl£¬ĀČĄė×Ó¼ģŃé·½·ØŹĒ£ŗȔɣĮæFČÜŅŗÓŚŹŌ¹ÜÖŠ£¬ĻņČÜŅŗÖŠĻČ¼ÓÉŁĮæĻ”ĻõĖį£¬Č»ŗóµĪ¼ÓĻõĖįŅųČÜŅŗ£¬Čē¹ū²śÉś°×É«³Įµķ£¬¾ĶĖµĆ÷ŗ¬ÓŠĀČĄė×Ó£¬·ńŌņ²»ŗ¬ĀČĄė×Ó£¬¹Ź“š°øĪŖ£ŗȔɣĮæFČÜŅŗÓŚŹŌ¹ÜÖŠ£¬ĻņČÜŅŗÖŠĻČ¼ÓÉŁĮæĻ”ĻõĖį£¬Č»ŗóµĪ¼ÓĻõĖįŅųČÜŅŗ£¬Čē¹ū²śÉś°×É«³Įµķ£¬¾ĶĖµĆ÷ŗ¬ÓŠĀČĄė×Ó£¬·ńŌņ²»ŗ¬ĀČĄė×Ó£®
µćĘĄ ±¾ĢāŅŌClŌŖĖŲĪŖŌŲĢåæ¼²éĪŽ»śĶʶĻ£¬ĪŖøßĘµæ¼µć£¬Ć÷Č·ĪļÖŹŠŌÖŹ¼°ĪļÖŹÖ®¼äÖ»ŗ¬ŹĒ½ā±¾Ģā¹Ų¼ü£¬²ąÖŲæ¼²éѧɜÖŖŹ¶×ŪŗĻÓ¦ÓĆÄÜĮ¦£¬ŹģĮ·ÕĘĪÕĪļÖŹŠŌÖŹ¼°Ąė×Ó¼ģŃé·½·ØŗĶĻÖĻó£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
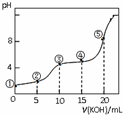 ³£ĪĀĻĀ£¬ÓĆ0.05mol•L-1 KOHČÜŅŗµĪ¶Ø 10.00mL0.05mol•L-1 H2C2O4£Ø¶žŌŖČõĖį£©ČÜŅŗĖłµĆµĪ¶ØĒśĻßČēĶ¼£ØĢå»ż±ä»ÆŗöĀŌ²»¼Ę£©£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©
³£ĪĀĻĀ£¬ÓĆ0.05mol•L-1 KOHČÜŅŗµĪ¶Ø 10.00mL0.05mol•L-1 H2C2O4£Ø¶žŌŖČõĖį£©ČÜŅŗĖłµĆµĪ¶ØĒśĻßČēĶ¼£ØĢå»ż±ä»ÆŗöĀŌ²»¼Ę£©£®ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø””””£©| A£® | µć¢ŚČÜŅŗÖŠ£ŗc£ØK+£©+c£ØH+£©=c£ØHC2O4-£©+c£ØC2O42-£©+c£ØOH-£© | |
| B£® | µć¢ŪČÜŅŗÖŠ£ŗc£ØK+£©=c£ØHC2O4-£©+c£ØC2O42-£©+c£ØH2C2O4£© | |
| C£® | µć¢ÜČÜŅŗÖŠ£ŗc£ØK+£©+c£ØH2C2O4£©+c£ØHC2O4-£©+c£ØC2O42-£©=0.05 mol•L-1 | |
| D£® | µć¢ŻČÜŅŗÖŠ£ŗc£ØK+£©£¾c£ØHC2O4-£©£¾c£ØC2O42-£©£¾c£ØOH-£©£¾c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
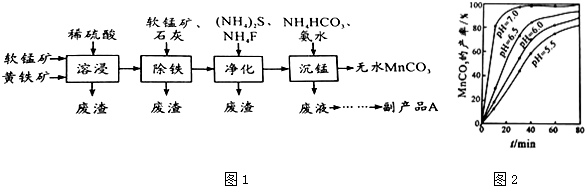
 ŅõĄė×ÓŗĶBa£ØNO3£©2·“Ӧɜ³É²»ČÜÓŚŃĪĖįµÄ°×É«³Įµķ£®DµÄÅØČÜŅŗÓėKMnO4»ģŗĻ£¬Éś³ÉµÄĘųĢåÄÜŹ¹ŹÆČļČÜŅŗĶŹÉ«£¬AµÄĖ®ČÜŅŗĻŌĖįŠŌ£®ÓĆ»ÆѧŹ½±ķŹ¾A”¢B”¢C”¢D”¢Eø÷ŹĒŹ²Ć“ĪļÖŹ£®Š“³öÓŠ¹Ų»Æѧ·½³ĢŹ½£®
ŅõĄė×ÓŗĶBa£ØNO3£©2·“Ӧɜ³É²»ČÜÓŚŃĪĖįµÄ°×É«³Įµķ£®DµÄÅØČÜŅŗÓėKMnO4»ģŗĻ£¬Éś³ÉµÄĘųĢåÄÜŹ¹ŹÆČļČÜŅŗĶŹÉ«£¬AµÄĖ®ČÜŅŗĻŌĖįŠŌ£®ÓĆ»ÆѧŹ½±ķŹ¾A”¢B”¢C”¢D”¢Eø÷ŹĒŹ²Ć“ĪļÖŹ£®Š“³öÓŠ¹Ų»Æѧ·½³ĢŹ½£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ŹµŃé×éŠņ | ĪĀ¶Č/”ę | ĘšŹ¼Įæ/mol | Ę½ŗāĮæ/mol | ||||
| CO£Øg£© | H2£Øg£© | CH3OH£Øg£© | CH3OH£Øg£© | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
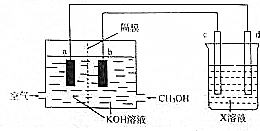
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com