
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g 时,隔板处于如图位置(保持温度不变),下列说法正确的是

A. 右边CO与CO2分子数之比为1:3
B. 右侧CO的质量为14g
C. 右侧气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为5: 6
【答案】D
【解析】图中两边的气体压强相同,则气体体积比等于物质的量之比,说明一氧化碳和二氧化碳的物质的量的和为2摩尔,设一氧化碳为xmol,二氧化碳为ymol,则有x+y=2 , 28x+44y=64,解x=1.5,y=0.5。A.一氧化碳和二氧化碳的分子数比等于其物质的量比,为3:1,故错误;B.一氧化碳的质量为1.5×28=42g,故错误;C.根据相同的压强下,密度比等于相对分子质量之比,右侧的气体的相对分子质量等于64/2=32,与同温同压下氧气的相对分子质量相同,所以二者密度比为1:1,故错误;D. 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则氮气占总体积的2/3,根据同温下,物质的量相同的氮气体积与压强成反比,所以前后压强比为2/3:4/5=5:6,故正确。故选D。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】POCl3广泛用于染料等工业。某化学学习小组借助拉瓦锡研究空气成分的曲颈甑(装置甲)合成PC13,并采取PCl3氧化法制备POCl3。
已知:(1)PCl3的熔点为-112℃,沸点为75.5℃,遇水生成H3PO3和HCl;
(2)2PCl3+O2==2POCl3。
【实验Ⅰ】制备PCl3
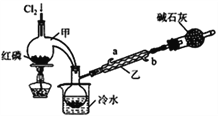
(1)实验室制备Cl2的原理是________________________。
(2)碱石灰的作用除了处理尾气外还有________________________。
(3)装置乙中冷凝水从_____(选填a或b)进入。
【实验Ⅱ】制备POCl3
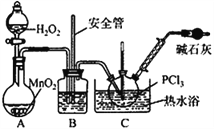
(4)实验室常用有微孔的试剂瓶保存H2O2,“微孔”与上述装置中的___________(仪器名称)目的是一致的。
(5)C中反应温度控制在60~65℃,其原因是________________________。
【实验Ⅲ】测定POCl3含量
①准确称取30.70gPOC13产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;
②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;
③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;
④以Fe3+ 为指示剂,用0.2000mol/LKSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
已知:Ag++SCN-==AgSCN↓ Ksp(AgCl)>Ksp(AgSCN )。
(6)POC13水解的化学反应方程式为________________________。
(7)滴定终点的现象为____________,用硝基苯覆盖沉淀的目的是________________________。
(8)反应中POC13的百分含量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列四种物质,①NA个HCl ②24gCH4 ③4.816×1023个H2O2分子 ④10.8mL水(密度为1g·cm-3)。
ⅰ.四种物质所含分子数由多到少的顺序是:_________________________________;
ⅱ.四种物质所含原子数由多到少的顺序是:_________________________________;
ⅲ.四种物质所含H由多到少的顺序是:_____________________________________;
ⅳ.四种物质的质量由多到少的顺序是:_____________________________________。
(2)H2O与CO2的质量比为18:22,则H2O和CO2的物质的量之比为________,分子个数比为_______,原子个数比为__________,所含氧原子个数比为___________。
(3)在标准状况下,等质量的O3和CO2比较,密度比为________,分子数之比为_________,原子数之比______,体积比为_______,物质的量之比__________。
(4)CH4与H2的混合气体,其质量百分含量分别为80%、20%,则混合气体的平均相对分子质量为__________。
(5)标准状况下,某气体密度为1.96g/L,则该气体的摩尔质量为_____(保留整数)
(6)把100克某NaOH溶液(密度是1.22g/cm3)蒸发浓缩,余下溶液50ml时,物质的量浓度是8mol/L,原溶液的物质的量浓度是 _________________。
(7)已知Na2S、Na2SO3、Na2SO4混合物中硫元素的质量分数为a%,则氧元素的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如下:


(1)A的名称是_______________,A分子中最多有_____个原子共平面。
(2)B生成A的化学方程式______________________。
(3)D生成E的反应类型为_________,试剂a是_________。
(4)F的结构简式_____________________。
(5)J是一种酯,分子中除苯环外还含有一个五元环。写出H生成J的化学方程式_____(注明反应条件)。
(6)![]() ,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
,X的同分异构体中:①能发生银镜反应;②能与氯化铁溶液发生显色反应。满足上述条件的X的同分异构体共有______种,写出其中核磁共振氢谱有五组吸收峰的结构简式___________________。
(7)利用题中信息和所学知识,写出以甲烷和化合物D为原料,合成 ![]() 的路线流程图____________________(其它试剂自选)。
的路线流程图____________________(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)在配制一定体积的溶液中,下列操作使得到的溶液浓度偏高、偏低还是无影响?
①将溶解溶质的烧杯内的液体倒入容量瓶后,未洗涤烧杯就进行定容。_______
②定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸
出___________
③定容摇匀后,发现瓶内液面略低于瓶颈刻度线。______________
④配置稀硫酸时,若所用的浓硫酸长时间放置在密封不好的容器中,将使溶液浓度______________
(2)认装置如图,并填空:
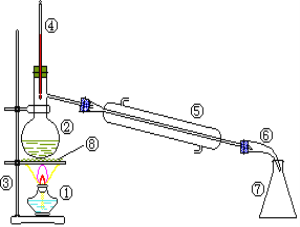
写出装置中各仪器的名称(编号和名称要对应):
②_______________、⑤_______________。实验时要在②中加入__________________,防止_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列药品对应的临床应用正确的是( )
A. 麻黄碱适合于医治因葡萄球菌和链球菌等引起的血毒症
B. 毒品就是有毒的药品
C. 我国明代医学家李时珍所著的医学名著是《神农本草经》
D. 麻黄碱是国际奥委会严格禁止使用的兴奋剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在标准状况下的四种气体①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3,密度最大的是_____(填序号)。
(2)标准状况下,甲烷和一氧化碳的混合气体共8.96L,其质量为7.6g,则混合气体中甲烷的体积分数为_______。
(3)某物质A加热时按化学方程式2A═2B+C+3D分解,产物均为气体,测得由生成物组成的混合物气体对H2的相对密度为20,则反应物A的摩尔质量为____________。
(4)80 g密度为1 gcm-3的CaCl2溶液里含2 g Ca2+,从中再取出一半的溶液中Cl-的物质的量浓度是_______。
(5)10 mL 0.1 mol·L-1 BaCl2溶液恰好使相同体积的硫酸铁、硫酸铜两种溶液中的SO42-完全转化成沉淀,则硫酸铁、硫酸铜两种溶液的物质的量浓度之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2是一种性能优良的半导体光催化剂,能有效地吸附有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质。
(1)Ti基态核外电子排布式为________________。
(2)甲醛HCHO分子空间构型为_____;分子中碳原子轨道杂化类型为_____,π键和σ键的个数之比为____,
(3)氨气极易溶于水,是因为氨和水的分子均是_________,还因为___________。
(4)甲苯分子中能够共平面的原子最多为____个;苯环不易被卤素加成,而比较容易被卤素取代苯环上的氢,原因是___________________。
(5)含CN-的污水毒性极大,用NaClO先把CN-氧化为CNO-,然后在酸性条件下再将CNO-氧化为无污染的气体。请写出与CNO-互为等电子体的微粒______分子或离子,写一种)。
(6)Ti[(CN)4]2-中Ti2+与CN-的C原子形成配位键。不考虑空间构型,Ti[(CN)4]2-的结构可表示为_____________________。
(7)Ti的某氧化物和CaO相互作用能形成钛酸盐的晶胞结构如图所示(Ti4+位于立方体的顶点,Ca2+ 处于立方体的中心)。该晶体中,Ti4+和周围____ 个O2-相紧邻;若该晶胞的密度为dg/cm3则钛氧键的键长为______pm (用带NA的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com