
【题目】微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用。
(1)写出基态B原子的轨道表达式___________________。
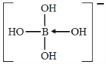
(2)三价B易形成配离子,如[B(OH)4]-、[BH4]-等。[B(OH)4]-的结构式为___________________ (标出配位键),其中心原子的杂化方式为式________,写出[BH4]-的两种等电子体________________。
(3)图1表示多硼酸根的一种无限长的链式结构,其化学式可表示为____________(以n表示硼原子的个数)。

(4)硼酸晶体是片层结构,图2表示的是其中一层的结构。层间存在的作用力有_________________;硼酸晶体在冷水中溶解度很小,但在热水中较大,原因是_____________________。
(5)三氯化硼的熔点比氯化镁的熔点低,原因是_________________________________________。
(6)镁属六方最密堆积(图3),其晶胞结构如图4所示,若镁原子半径为apm,则镁晶体的密度为_________________________________g/cm3(用含a的代数式表示)。

【答案】 ![]()
 sp3 CH4 、NH4+ (BO2)nn- 氢键、范德华力 晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大 三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱
sp3 CH4 、NH4+ (BO2)nn- 氢键、范德华力 晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,溶解度增大 三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱 ![]()
【解析】(1)B的原子序数是5,基态B原子核外电子排布式为1s2s22p1,所以轨道表达式为![]() 。(2)三价B易形成配离子,因此在[B(OH)4]-中氧原子提供孤对电子,则[B(OH)4]-的结构式为
。(2)三价B易形成配离子,因此在[B(OH)4]-中氧原子提供孤对电子,则[B(OH)4]-的结构式为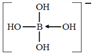 。B的价层电子对数是4,则其中心原子的杂化方式为式为sp3。原子数和价电子数分别都相等的是等电子体,则[BH4]-的两种等电子体分别是 CH4、NH4+。(3)从图可看出,每个单元都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个单元共用,所以B:O=1:(1+2×1/2)=1:2,化学式为(BO2)nn-;(4)氧原子能与氢元素形成氢键,因此层间存在的作用力有氢键、范德华力;由于晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,导致溶解度增大。(5)三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱,所以氯化镁的熔点高于三氯化硼。(6)镁属六方最密堆积,若镁原子半径为apm,底面积是(2a×10-10)2cm2,体对角线是4a×10-10cm,面对角线是
。B的价层电子对数是4,则其中心原子的杂化方式为式为sp3。原子数和价电子数分别都相等的是等电子体,则[BH4]-的两种等电子体分别是 CH4、NH4+。(3)从图可看出,每个单元都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个单元共用,所以B:O=1:(1+2×1/2)=1:2,化学式为(BO2)nn-;(4)氧原子能与氢元素形成氢键,因此层间存在的作用力有氢键、范德华力;由于晶体中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,导致溶解度增大。(5)三氯化硼为分子晶体,而氯化镁为离子晶体,范德华力比离子键弱,所以氯化镁的熔点高于三氯化硼。(6)镁属六方最密堆积,若镁原子半径为apm,底面积是(2a×10-10)2cm2,体对角线是4a×10-10cm,面对角线是![]() ,所以高是
,所以高是![]() ,晶胞体积是
,晶胞体积是![]() ,则镁晶体的密度为
,则镁晶体的密度为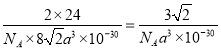 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 石油的产量是衡量一个国家化学工业水平的标志
B. 石油裂化既能提高汽油产量,又能提高汽油的质量
C. 石油的裂解和裂化都是化学变化,但二者的目的不一样
D. 烷烃在裂解过程中既可发生断链裂解又可发生脱氢裂解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
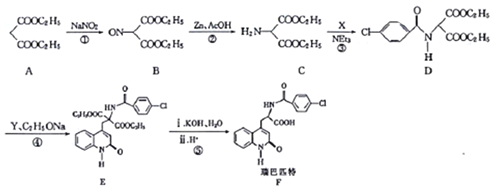
已知:Y的结构简式为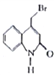
(1)A的化学名称为_______,A与足量NaOH溶液反应的化学方程式为___________。
(2)化合物C中官能团的名称为________。
(3)反应①的反应类型为______,反应②的反应类型为__________。
(4)C→D的转化过程中,生成的另一种产物为HCl,则X的结构简式为__________。
(5)芳香族化合物Z是X的同分异构体,能发生银镜反应且Z的核磁共振氢谱中有3组峰,则Z的结构简式为______(任写一种)。
(6)已知:①![]() HOCH2CH2CHO
HOCH2CH2CHO
②CH3CH2OH![]() CH3CH2Br。
CH3CH2Br。
请写出以A和![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备![]() 的合成路线流程图____。合成路线流程图示例如下:
的合成路线流程图____。合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学物质在生活、生产的运用描述不正确的是
A. 氢氧化钠能与二氧化硅反应,故常用氢氧化钠在玻璃上进行刻画
B. 工业上常用氨气来检查氯气管道是否泄漏
C. 氧化铝俗名刚玉,耐磨,常用于做轴承材料
D. 钠和鉀的合金呈液态,常做核反应堆的导热剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物。m、n分别是元素Y、Z的单质,n通常为深红棕色液体,0.01 mol/L r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。上述物质的转化关系如图所示。下列说法不正确的是( )
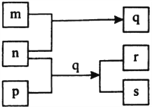
A. 原子半径的大小W<X<Z
B. W的氧化物常温常压下为液态
C. Y的氧化物可能呈黑色或红棕色
D. Z的氧化物的水化物一定为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】屈昔多巴( )可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等。以下是屈昔多巴的一种合成路线(通常
)可治疗直立性低血压所致头昏、头晕和乏力,帕金森病患者的步态僵直等。以下是屈昔多巴的一种合成路线(通常![]() 简写为BnCl,
简写为BnCl,![]() 简写为CbzCl ):
简写为CbzCl ):

回答下列问题:
(1)反应①的反应类型为_____________,其作用为_________________。
(2)屈昔多巴中所含的非含氧官能团名称为_______________,屈昔多巴分子中有___________个手性碳原子。
(3)反应②为加成反应,有机物X的名称为______________________。
(4)![]() 显________________性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:_______________________。
显________________性(填“酸”、“中”或“碱”),写出其与盐酸反应的化学方程式:_______________________。
(5)![]() 的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_______种,其中核磁共振氢谱为四组峰的结构简式为______________(任写一种)。
的同分异构体中,能与NaHCO3溶液反应生成CO2的二取代芳香化合物有_______种,其中核磁共振氢谱为四组峰的结构简式为______________(任写一种)。
(6)参照上述合成路线,以对羟基苯甲醛为原料(无机试剂任选),设计制备对羟基苯甲酸的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1 mol Na2CO3与稀盐酸混合所得的体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是
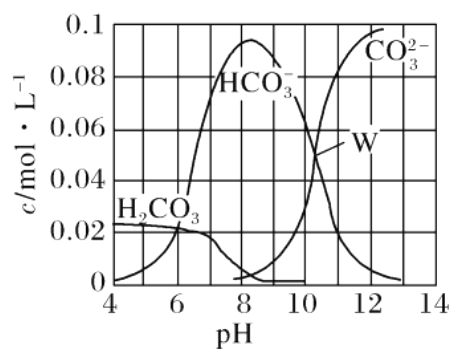
A. W点所示的溶液:c(Na+)>c(CO![]() )=c(HCO
)=c(HCO![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B. pH=4的溶液:c(H2CO3)+c(HCO![]() )+c(CO
)+c(CO![]() )=0.1 mol·L-1
)=0.1 mol·L-1
C. 向pH=8的溶液中通入CO2至pH=7所得的溶液:c(Na+)>c(Cl-)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D. pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够说明在恒温恒容下的密闭容器中,反应2SO2+O2![]() 2SO3,已达平衡状态的标志是
2SO3,已达平衡状态的标志是
A. SO2和SO3的物质的量浓度相等
B. 反应容器内气体的密度不随时间变化而变化
C. 单位时间内生成2mol SO3时,同时生成lmolO2
D. 容器中SO2、O2、SO3的物质的量之比为2:l:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com