
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
| KMnO4酸性溶液的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
| 实验编号 | 20℃下,试管中所加试剂及其用量/mL | 20℃下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | V1 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | V2 | 6.4 |
分析 (1)据氧化还原反应中得失电子相等和原子守恒书写离子方程式;
(2)根据实验的目的和影响化学反应速率的因素来设计实验;
(3)影响化学反应速率的因素有温度、浓度、压强、催化剂和接触面积,据此结合该反应特点进行分析;
(4)①先求出反应开始时c(KMnO4),然后求出三次褪色的平均时间,最后根据ν(KMnO4)=$\frac{△c}{△t}$进行计算;
②因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较;如想通过直接观察褪色时间长短来判断必须保证高锰酸钾的体积与浓度相同,草酸过量;
③只改变KMnO4酸性溶液的浓度,硫酸的用量相同,都是2.0mL,通过加蒸馏水使溶液总体积不变.
解答 解:(1)草酸使酸性高锰酸钾褪色,是+7价的Mn氧化了草酸根,Mn变为+2价,C变为+4价,生成二氧化碳,据氧化还原反应中得失电子相等和原子守恒书写离子方程式为:5H2C2O4十2MnO4-十6H+=2Mn2+十10CO2↑十8H2O,
故答案为:5H2C2O4十2MnO4-十6H+=2Mn2+十10CO2↑十8H2O;
(2)由实验目的可知,探究浓度、温度、接触面积对化学反应速率的影响,
实验①和②探究KMnO4酸性溶液的浓度对反应速率的影响,则实验①②的温度、催化剂的用量相同,只有浓度不同;实验①③的温度不同,则实验目的是探究温度对化学反应速率的影响,则①③中只有温度不同,其他条件相同;实验①④应该是探究催化剂对反应速率的影响,则①④中只有催化剂的用量不同,其他条件相同,据此完成表格为:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | 298 | 0.5 | 0.001 | |
| ③ | 323 | 0.5 | 0.01 | |
| ④ | 298 | 0 | 0.01 |
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | 298 | 0.5 | 0.001 | |
| ③ | 323 | 0.5 | 0.01 | |
| ④ | 298 | 0 | 0.01 |
点评 本题考查了探究影响化学反应速率的因素的方法,熟练掌握外界条件对化学反应速率的影响为解答关键,注意明确设置对照试验的原则,试题侧重考查学生的分析能力及化学实验能力,题目难度中等.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5ClBr | B. | C3H6Cl2 | C. | C4H8Br2 | D. | C3H4I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
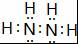 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ②③④ | C. | ②③⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g 铜与S完全反应,电子转移0.1 NA个 | |
| B. | 标准状况下,2.24 L水中含有0.1 NA个水分子 | |
| C. | 1.12 L氯气中含有0.1 NA个氯原子 | |
| D. | 0.3molNO2与H2O反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 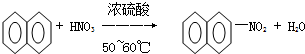 | |
| B. |  | |
| C. | CH3CHO+H2$→_{催化剂}^{高温高压}$CH3CH2OH | |
| D. | 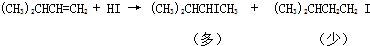 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com