
| 实验步骤 | 预期现象和结论 |
| 步骤1:向盛有固体K2Cr2O7的A、B两试管中分别加入一定量的稀硫酸 | |
| 步骤2: | |
| 步骤3: |
| ||
| 步骤2:向A试管中加入适量NaCl固体,加热,把湿润的淀粉KI试纸放在试管口附近 | ㈠若试纸变蓝,则假设1成立; ㈡若试纸未变蓝,则假设2或3成立 |
| 步骤3:向B试管中加入适量浓硫酸,加热,把湿润的淀粉KI试纸放在试管口附近 | ㈠若试纸变蓝,则假设2成立 ㈡若试纸未变蓝,结合步骤2中的㈡,则假设3成立 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | ||||
B、用惰性电极电解NaHS溶液:HS-+H2O
| ||||
| C、向摩尔盐溶液中加入过量的Ba(OH)2溶液:2NH4++Fe2++2SO42-+2Ba2++4OH-=2BaSO4↓+Fe(OH)2↓+2NH3.H2O | ||||
| D、明矾溶液中加入Ba(OH)2溶液至生成的沉淀质量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 |
| B、向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 |
| C、向0.0008 mol?L-1的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 6 |
| a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| H+ |

查看答案和解析>>
科目:高中化学 来源: 题型:
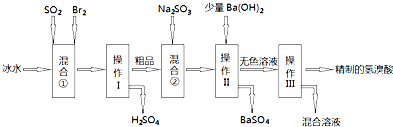
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
A、△H4=
| ||
B、△H4=
| ||
C、△H4=
| ||
D、△H4=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com