

分析 工业废水中含有CuSO4,少量的Ag+、Hg2+以及部分污泥,分离不溶性固体和溶液采用过滤的方法,向澄清溶液中加入Cu,Cu和Ag+、Hg2+发生置换反应生成金属单质Hg和Ag,然后采用过滤的方法分离,然后将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、烘干的方法制取胆矾.
解答 解:工业废水中含有CuSO4,少量的Ag+、Hg2+以及部分污泥,分离不溶性固体和溶液采用过滤的方法,向澄清溶液中加入Cu,Cu和Ag+、Hg2+发生置换反应生成金属单质Hg和Ag,然后采用过滤的方法分离,然后将硫酸铜溶液蒸发浓缩、冷却结晶、过滤、烘干的方法制取胆矾.
(1)通过以上分析知,步骤1的主要操作是过滤,需用到的玻璃仪器除烧杯外,还有起引流作用的玻璃棒、过滤作用的漏斗,故答案为:过滤;玻璃棒、漏斗;
(2)通过以上分析知,步骤2中需加入某种试剂后再将混合物分离,该试剂是Cu,
故答案为:Cu;
(3)步骤2应该在通风橱中进行,原因是Hg有毒且有挥发性,易使人产生中毒;铜和Ag+、Hg2+发生置换反应生成金属单质Hg和Ag,所以固体残渣的成分是Ag和Cu,
故答案为:Hg有毒且有挥发性;Ag和Cu;
(4)步骤3中涉及的操作是:蒸发浓缩、冷却结晶、过滤、烘干,故答案为:冷却结晶;
点评 本题考查了物质的分离和提纯,从整体把握物质分离和提纯流程图,知道各个步骤采用的分离方法、可能发生的反应等知识点,再结合物质的性质分析解答,易错点是(2),注意滤渣中还含有过量的Cu,不能含有Hg,因为Hg常温下呈液态,为易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).
利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为LiOH溶液(填化学式),阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Li+向B电极迁移(填“A”或“B”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. +3HNO3
+3HNO3
 +3H2O;
+3H2O;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Cl-、NO3-、Na+、SO32- | |
| B. | c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br- | |
| C. | Na2S溶液中 SO42-、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 NO3-、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
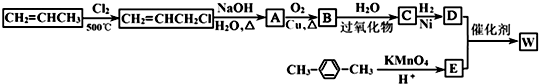
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
 .
. .
. .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com