
| A. | 乙醇和乙酸分子都能和金属钠反应 | |
| B. | 乙酸能溶于水,但不溶于乙醇 | |
| C. | 乙醇和乙酸均能使紫色石蕊试液变红 | |
| D. | 乙醇和乙酸互为同分异构体 |
科目:高中化学 来源: 题型:解答题
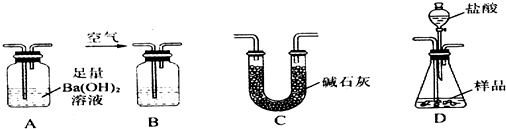
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
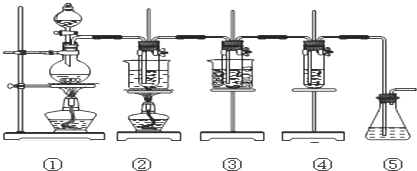
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | HClO有强氧化性,体现漂白作用是其褪色 |
| 然后溶液从无色逐渐变为浅绿色 | 溶液中溶解了大量的氯气,体现浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 硫酸钠溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| C. | 盐酸滴在石灰石上:CaCO3+2H+═H2CO3+Ca2+ | |
| D. | 氧化铜与硫酸混合:Cu2++SO42-═CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
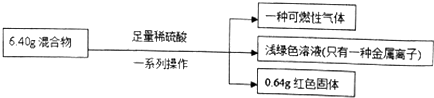
| A. | 原混合物中铜元素的质量一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
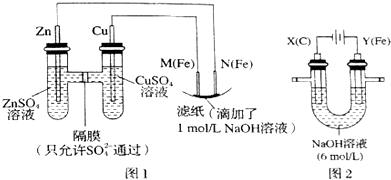
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 钢 | |||
| 碳素钢(Fe、C、Mn、Si) | 合金钢 | ||
| 低碳钢 | 中碳钢 | 高碳钢 | 碳素钢+Cr、Mn、W、Ni、Co等 |
| 含碳量<0.3% | 含碳量0.3%~0.6% | 含碳量>0.6% | |
| 韧性好,强度低 | 韧性好、强度好 | 硬而脆 | 具有特殊性能 |
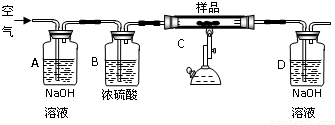
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3?H2O能大量共存 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com