

分析 (1)根据盖斯定律,②式-③式可得①式的△H1;
由a图定温度,压强由0.1MPa变化到xMPa,丁烷的转化率增大,即平衡正向移动,结合反应前后气体体积的变化分析x;
要使丁烯的平衡产率增大,需通过改变温度和压强使平衡正向移动;
(2)丁烷分解产生丁烯和氢气,增加氢气的量会促使平衡逆向移动,丁烯的产率下降;
(3)升温速率加快,单位时间内生成丁烯更多,升温反应①平衡正向移动,丁烯产率增加;
由题中信息可知丁烷高温会裂解生成短链烃类,所以当温度超过590℃时,部分丁烷裂解导致产率降低.
解答 解:(1)②C4H10(g)+$\frac{1}{2}$O2(g)=C4H8(g)+H2O(g)△H2=-119kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H3=-242kJ•mol-1
②-③得C4H10(g)=C4H8(g)+H2(g)△H1=+123kJ•mol-1
由a图可知温度相同时,由0.1MPa变化到xMPa,丁烷转化率增大,即平衡正向移动,该反应是气体体积增大的反应,所以x的压强更小,x<0.1;
由于反应①为吸热反应,温度升高时,平衡正向移动,丁烯的平衡产率增大,反应①正向进行时体积增大,减压时平衡正向移动,丁烯的平衡产率增大,因此AD正确,
故答案为:+123;小于;AD;
(2)丁烷分解产生丁烯和氢气,一开始充入氢气是为活化催化剂,同时氢气作为反应①的产物,增大氢气的量会促使平衡逆向移动,从而减少平衡体系中的丁烯的含量,使丁烯的产率降低,
故答案为:原料中过量H2会使反应①平衡逆向移动,所以丁烯产率下降;
(3)590℃之前,温度升高时反应速率加快,单位时间内生成的丁烯会更多,同时由于反应①是吸热反应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯;
而温度超过590℃时,由于丁烷高温会裂解生成短链烃类,所以参加反应①的丁烷也就相应减少,产率下降,
故答案为:升高温度时,反应速率加快,单位时间产生丁烯更多;590℃前升高温度,反应①平衡正向移动;高温则有更多的丁烷裂解生成副产物导致产率降低.
点评 本题考查盖斯定律以及化学平衡的影响因素,为高频考点,把握图象分析温度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意化学平衡在实际生产中的应用,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 可用于制备苏打 | B. | 可用于糕点生产中 | ||
| C. | 与H+作用易产生CO2 | D. | 可用饱和食盐水与CO2反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )| A. | Ts是第七周期第ⅦA族元素 | |
| B. | Ts的同位素原子具有相同的电子数 | |
| C. | Ts在同族元素中非金属性最弱 | |
| D. | 中子数为176的Ts核素符号是${\;}_{117}^{176}$Ts |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石灰、碳酸钠等碱性物质处理废水中的酸 | |
| B. | 用可溶性的铝盐和铁盐处理水中的悬浮物 | |
| C. | 用氯气处理水中的Cu2+、Hg2+等重金属离子 | |
| D. | 用烧碱处理含高浓度NH4+的废水并回收利用氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
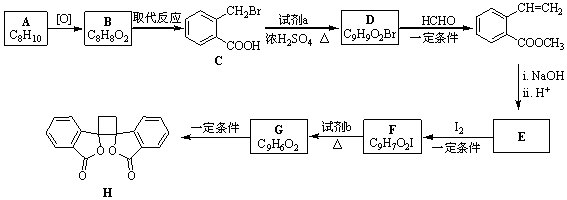
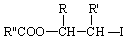
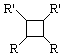
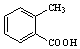 .
.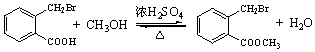 .
. ;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是
;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是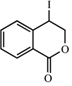 .
.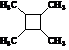 路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:C<O<N | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
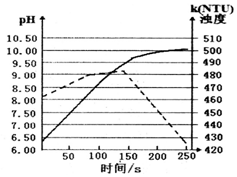 将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )| A. | 该实验是在常温下进行的 | |
| B. | 实线表示溶液浊度随时间的变化 | |
| C. | 50s时向溶液中滴入酚酞试液,溶液变红 | |
| D. | 150s后溶液浊度下降是因为生成的Mg(OH)2沉降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com