
分析 (1)某元素电子层数与最外层电子数相等,假设含有1个电子层、两个电子层、三个电子层,则最外层电子数分别为1、2、3;
(2)最外层电子数不能超过8个,如果K层是最外层,则不能超过2个,如果某种元素最外层电子数是次外层的2倍,其次外层只能是K层,据此判断元素;
(3)某元素次外层电子数是最外层电子数的2倍,如果L层为最外层,则其最外层电子数是1,如果M层是其最外层,则M层电子数为4.
解答 解:(1)某元素电子层数与最外层电子数相等,假设含有1个电子层、两个电子层、三个电子层,则最外层电子数分别为1、2、3;有1个电子层,且最外层电子数1的元素为H;有2个电子层,且最外层电子数2的元素为Be;有3个电子层,且最外层电子数3的元素为Al;
故答案为:H、Be、Al;
(2)最外层电子数不能超过8个,如果K层是最外层,则不能超过2个,如果某种元素最外层电子数是次外层的2倍,其次外层只能是K层,则其最外层电子数是6,为C元素;
故答案为:C;
(3)某元素次外层电子数是最外层电子数的2倍,如果L层为最外层,则其最外层电子数是1,为Li元素,如果M层是其最外层,则M层电子数为4,为Si元素;
故答案为:Li或Si.
点评 本题考查元素位置、结构与性质,为高频考点,明确原子核外电子排布及原子结构即可解答,熟练掌握短周期元素核外电子排布,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑥⑦ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
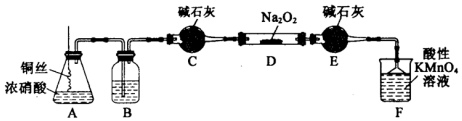
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMn04溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
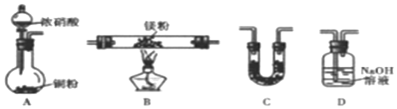
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 实验 | 分离汽油和水 | 通过蒸馏乙醇的水溶 液获得无水乙醇 | 分离 CCl4 中的 I2 | 除去 CO2 气体中的 HCl 气体 |
| 装 置 或 仪 器 | 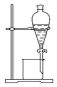 | 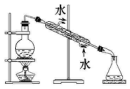 | 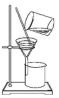 | 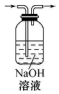 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
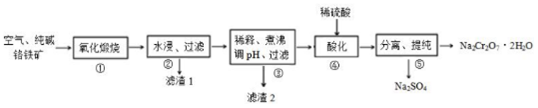
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
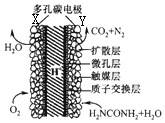 直接尿素电池的结构如图所示,下列说法不正确的是( )
直接尿素电池的结构如图所示,下列说法不正确的是( )| A. | 电池工作时,化学能转化为电能 | |
| B. | 电池工作时,H+向Y极区迁移,Y极周围溶液的pH减小 | |
| C. | 碳电池采用多孔并用触媒层可加快反应速率 | |
| D. | Y极的电极反应式为H2NCONH2+H2O-6e-═N2↑+CO2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com