

分析 NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,同时得到Na2SO4,然后与过氧化氢在碱性条件下反应生成NaClO2,将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO3,母液中主要含有Na2SO4.
(1)ClO2发生器中发生反应:2NaClO3+SO2=2ClO2↑+Na2SO4,纯ClO2易分解爆炸,稀释ClO2以防止爆炸;
(2)吸收塔内是ClO2与氢氧化钠、过氧化氢反应生成NaClO2,过氧化氢起还原剂作用生成氧气;低于38℃析出NaCl02•3H2O,实际控制温度20℃,可能是温度过高时过氧化氢发生分解;
(3)从“母液”中可回收的主要物质是硫酸钠;
(4)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制,防止NaClO2分解成NaClO3和NaCl,防止析出NaCl02•3H2O晶体;
(5)由题目离子方程式可得关系式:NaClO2~2I2~4Na2S2O3,根据关系式计算解答.
解答 解:NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,同时得到Na2SO4,然后与过氧化氢在碱性条件下反应生成NaClO2,将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO3,母液中主要含有Na2SO4.
(1)ClO2发生器中发生反应:2NaClO3+SO2=2ClO2↑+Na2SO4,反应离子方程式为:2ClO3-+SO2=2ClO2↑+SO42-,纯ClO2易分解爆炸,稀释ClO2以防止爆炸,
故答案为:2ClO3-+SO2=2ClO2↑+SO42-;b;
(2)吸收塔内是ClO2与氢氧化钠、过氧化氢反应生成NaClO2,过氧化氢起还原剂作用生成氧气,反应方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;低于38℃析出NaCl02•3H2O,实际控制温度20℃,可能是防止温度过高时过氧化氢发生分解,
故答案为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2↑;防止H2O2分解;
(3)从“母液”中可回收的主要物质是Na2SO4,
故答案为:Na2SO4;
(4)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,为防止析出晶体NaClO2•3H2O,应趁热过滤,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;用38℃~60℃热水洗涤;
(5)由NaClO2~2I2~4Na2S2O3,可知25mol溶液中n(NaClO2)=$\frac{1}{4}$n(Na2S2O3)=$\frac{1}{4}$×0.0164L×2mol/L=0.0082mol,则m(NaClO2)=0.0082mol×90.5g/mol=0.7421g,得到样品中NaClO2的质量分数=$\frac{0.7421g×\frac{250mL}{25mL}}{10g}$×100%=74.21%,
故答案为:74.21%.
点评 本题考查物质制备实验,涉及物质分离提纯、氧化还原反应、物质含量测定、信息获取与运用等,侧重学生综合应用能力,题目难度中等.


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=4 | B. | 平衡向正反应方向移动 | ||
| C. | B的转化率降低 | D. | C的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
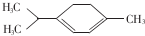 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②
②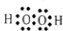 ③
③ ④
④ ⑤
⑤ ⑥
⑥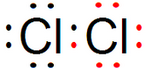 ⑦
⑦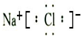
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去粗盐中不溶性杂质的操作有溶解、过滤、蒸发 | |
| B. | 教材上铝热反应实验中KClO3的作用是使镁带剧烈燃烧 | |
| C. | 石蜡油蒸气在炽热碎瓷片的作用下分解产生的气体可使酸性高锰酸钾溶液褪色 | |
| D. | 除去乙醇中少量的水采用加入新制的Ca(OH)2再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com