
【题目】在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
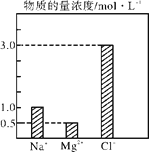
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
【答案】(1)0.24 11.4 (2)0.12 0.1 (3)0.72
【解析】
(1)根据图像可知钠离子的浓度是1.0mol/L,所以溶液中氯化钠的浓度是1.0mol/L,所以该混合液中,NaCl的物质的量为1.0mol/L×0.24L=0.24mol;溶液中镁离子的浓度是0.5mol/L,所以溶液中氯化镁的浓度是0.5mol/L,则含溶质MgCl2的质量为0.24L×0.5mol/L×95g/mol=11.4g;
(2)溶液中氯离子的浓度是3.0mol/L,所以根据溶液显电中性可知溶液中钙离子的浓度是![]() =0.5mol/L,因此该混合液中CaCl2的物质的量为0.5mol/L×0.24L=0.12mol;将该混合液加水稀释至体积为1.2 L,由于稀释后溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为
=0.5mol/L,因此该混合液中CaCl2的物质的量为0.5mol/L×0.24L=0.12mol;将该混合液加水稀释至体积为1.2 L,由于稀释后溶质的物质的量不变,则稀释后溶液中Ca2+的物质的量浓度为![]() ;
;
(3)溶液中氯离子的物质的量是0.24L×3mol/L=0.72mol,所以根据方程式Ag++Cl-=AgCl↓可知向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到氯化银沉淀的物质的量是0.72mol。


科目:高中化学 来源: 题型:
【题目】钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生 6.72 L(标准状况下)氮气,至少需要叠氮化钠_____g。
(2)为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究 性学习小组设计了如图发生装置.
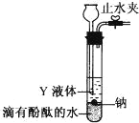
①写出 Na 与水反应的离子方程式_____。
②Y 液体可以选用_____
A.煤油 B.酒精 C.四氯化碳
③实验前检验该装置气密性的方法是:关闭止水夹,通过_________(填装置名称)向试管中加水至产生液面差,一段时间后,_____(填现象),则气密性良好。
(3)1mol 过氧化钠与 1.6mol 碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质及对应的物质的量(可不填满)。
物质 | 物质的量/mol |
__________ | __________ |
__________ | __________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M为海洋天然产物——PavidolideB不对称全合成的中间体之一,结构简式如下图。下列有关M的说法不正确的是

A. 分子式为C10H14O
B. 可发生加成反应、聚合反应
C. 分子中所有碳原子都在同一平面上
D. 苯环上连有-OH和-C4H9的M的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA
B. 7.8 g Na2O2中含有的阴离子数目为0.2NA
C. 将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA
D. 23 g Na 与足量H2O反应完全后可生成NA个H2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图1所示是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
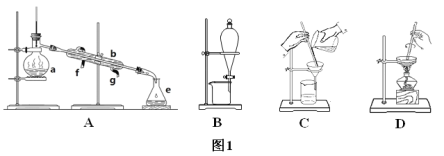
(1)从氯化钾溶液中得到氯化钾固体选择装置___(填代表装置图的字母,下同);除去自来水中的氯离子等杂质选择装置____。
(2)从碘水中分离出I2选择装置_____,该分离方法的名称为____。
(3)装置A中仪器a的名称是_____,进水的方向是____。
Ⅱ.海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图2流程的实验:

(1)粗盐中含Ca2+、Mg2+、SO42-等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有: ①加入过量的Na2CO3溶液②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④加入盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是(填写序号字母)______。
a.⑤②③①④⑥⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)由海水到氯化钠晶体的实验过程中要用到的主要装置是(从图1中给定的四种装置中选择)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,有物质①44.8LH2,②24gCH4,③1molH2O,④3.01×1023个O2,含分子数最多的是______(填序号,下同),含电子数最多的是______,质量最大的是______,体积最小的是______;密度由小到大的顺序为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是
A.含有NA个N的N2在标准状况下的体积约为22.4L
B.在常温常压下,11.2LCO2含有的分子数为0.5NA
C.标准状况下,11.2L氟化氢(沸点为19.54℃)中含有氟原子的数目为0.5 NA
D.3.2gO2和O3的混合物,所含氧原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
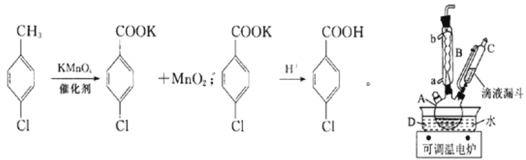
【题目】实验室中制备对氯苯甲酸的反应以及装置如图所示:
常温下,物质的有关数据和性质如表所示:
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的仪器A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩,冷却,然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量。
请回答下列问题:
(1)仪器A的名称为______________________。
(2)仪器B是冷凝管,其起到的主要作用是:________________,实验过程中,冷却水从________口。
(3)实验过程中两次过滤、洗涤操作,第一次过滤的滤渣成分为___________(填化学式),洗涤该滤渣用热水,目的是_________________________________,第二次过滤后,洗涤滤渣用冷水,目的是______________________。
(4)过滤、洗涤操作中能用到的仪器是___________(填选项字母)。
a.烧杯 b.分液漏斗 c.锥形瓶 d.玻璃棒
(5)第一次过滤后的滤液中加入硫酸,出现的现象是___________。
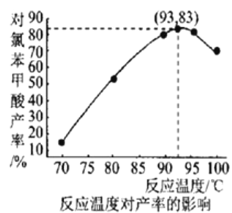
(6)如图是温度对对氯苯甲酸产率的影响关系,最后干燥、称量得到的对氯苯甲酸的质量为___________(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在银圈和铁圈之间用铂丝连接,联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液。
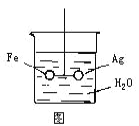
(1)片刻后可观察到的现象是__________________
(2)产生上述现象的原因是__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com