
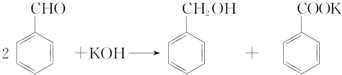
| 名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
| 苯甲醛 | 无色液体,苦杏仁味 | -26 | 178.1 | 1.041 5 | 微溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.265 9 | 微溶 |
| 苯甲醇 | 无色液体,有芳香味 | -15.3 | 205.35 | 1.041 9 | 微溶 |
| 乙醚 | 无色透明液体, 有特殊刺激性气味 | -116.3 | 34.6 | 0.71 | 不溶 |
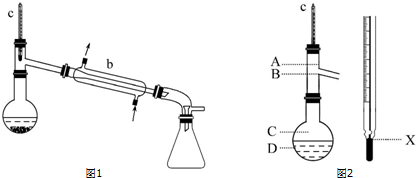
分析 苯甲醛与KOH反应生成白色糊状物为苯甲醇、苯甲酸钾的混合物,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,蒸馏、萃取得到产品甲为苯甲醇;依据蒸馏、萃取及物质的相关性质来解答.
(1)蒸馏装置中的仪器名称;
(2)苯甲醛容易被空气中的氧气氧化;
(3)若将苯甲醛一次性倒入锥形瓶,则反应太剧烈,混合液温度升高,导致苯甲醛、苯甲醇挥发,同时副产物增多,产率降低;
(4)分液漏斗使用前首先应检查是否漏液;
(5)无水硫酸镁起到干燥作用;
(6)蒸馏过程中,温度计的水银球上沿应与蒸馏支管下沿相平;
(7)蒸馏的混合液主要是乙醚和苯甲醇,根据它们的沸点,首先水浴蒸馏蒸出的是乙醚.根据沸点在178~180℃,该馏分应为苯甲醛.
解答 解:(1)蒸馏装置中的冷凝管,故答案为:冷凝管;
(2)苯甲醛容易被空气中的氧气氧化,因此锥形瓶要用胶塞塞住,故答案为:防止苯甲醛被空气中的氧气氧化;
(3)若将苯甲醛一次性倒入锥形瓶,则反应太剧烈,混合液温度升高,导致苯甲醛、苯甲醇挥发,同时副产物增多,产率降低,故答案为:A、D;
(4)分液漏斗使用前首先应检查是否漏液,故答案为:检查是否漏水(或检漏);
(5)无水硫酸镁起到干燥作用,故答案为:干燥乙醚萃取液;
(6)蒸馏过程中,温度计的水银球上沿应与蒸馏支管下沿相平,故答案为:B;
(7)蒸馏的混合液主要是乙醚和苯甲醇,根据它们的沸点,首先水浴蒸馏蒸出的是乙醚.根据沸点在178~180℃,该馏分应为苯甲醛,故答案为:乙醚,苯甲醛.
点评 本题考查制备方案的设计,为高频考点,题目难度中等,把握有机物的性质及分离流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:M>Z>Y>X | |
| B. | 气态氢化物:X<Z | |
| C. | X的氧化物一定是非极性分子 | |
| D. | Y单质可用于航空航天合金材料的制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 半反应式 | Fe2+表现的性质 | 完成该半反应式选用的物质 |
| A | Fe2++2e-═Fe | 氧化性 | I- |
| B | Fe2++2e-═Fe | 还原性 | Al |
| C | Fe2+-e-═Fe3+ | 氧化性 | Fe |
| D | Fe2+-e-═Fe3+ | 还原性 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
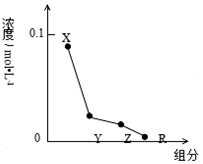
| A. | MOH的电离方程式:MOH═M++OH- | |
| B. | 该混合液中水电离出的c(H+)<l0-7mol/L | |
| C. | 该混合溶液中:c(Y)+c(X)═c(R)+c(Z) | |
| D. | 图中c(X)+c(Z)═0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
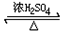 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 | B. | 0.7 | C. | 1.0 | D. | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.10mol•L-1的醋酸溶液和0.01mo•L-1的醋酸溶液中水的电离度 | |
| B. | 将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量 | |
| C. | 物质的量浓度相等的(NH4)2SO4溶液和(NH4)2SO3溶液中NH4+的浓度 | |
| D. | 物质的量浓度相等的CH3COONa溶液和 Na2CO3溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com