
【题目】X、Y、Z 为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:Y+X→甲(g),Y+Z→乙(g)。甲为10电子分子,Z为黄绿色气体。甲、乙可化合生成离子化合物。
(1)X 的电子式是__________,甲的结构式是__________。实验室制备Z的化学方程式___________________。
(2)写出Y+X→甲的化学方程式___________________。
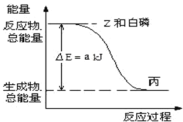
(3)已知常温下,![]() 为液体,
为液体,![]() 为固体。白磷
为固体。白磷![]() 在Z气体中燃烧生成液态丙分子,白磷固体和 Z 气体反应,生成1mol液态丙时,能量变化如图所示,写出该反应的热化学方程式_______________。
在Z气体中燃烧生成液态丙分子,白磷固体和 Z 气体反应,生成1mol液态丙时,能量变化如图所示,写出该反应的热化学方程式_______________。
已知1mol白磷固体和Z气体反应,生成固态丁时,放热b kJ,则1mol固态丁转化为液态丙时的反应热![]() _____。
_____。
【答案】![]()
![]()
![]()
![]()
![]() -(b/4-a)kJ · mol-1
-(b/4-a)kJ · mol-1
【解析】
X、Y、Z为不同短周期非金属元素的气态单质,Y+X→)甲(g),Y+Z→>乙(g),甲为10电子分子,Z为黄绿色气体,甲、乙可化合生成离子化合物,则该化合物为NH4Cl,则甲为NH3,乙为HCl,Y为H2,X为N2,Z为Cl2。
(1)X为N2,氮原子之间有3对共用电子对,电子式为:![]() ,甲是氨气,结构式为:
,甲是氨气,结构式为:![]() ,Z为Cl2,实验室制备氯气是用二氧化锰和浓盐酸加热生成氯化锰、氯气和水,化学方程式为:
,Z为Cl2,实验室制备氯气是用二氧化锰和浓盐酸加热生成氯化锰、氯气和水,化学方程式为:![]() ,故本题答案为:
,故本题答案为: ![]() ;
;![]() ;
;![]() ;
;
(2)Y+X→甲(g)的化学方程式为![]() ,故本题答案为:
,故本题答案为:![]() ;
;
(3)根据图象可知,白磷和氯气的总能量大于PCl3的能量,该反应为放热反应,所以热化学方程式为:![]() ,1mol白磷固体和氯气反应,生成固态PCl5时,放热b kJ,则1mol固态丁转化为液态丙时的反应热
,1mol白磷固体和氯气反应,生成固态PCl5时,放热b kJ,则1mol固态丁转化为液态丙时的反应热![]() =-(b/4-a)kJ · mol-1,故本题答案为:
=-(b/4-a)kJ · mol-1,故本题答案为:![]() ;-(b/4-a)kJ · mol-1;
;-(b/4-a)kJ · mol-1;


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要含3Al2O3·2SiO2、SiO2,还含有少量CaO、Fe2O3等物质)为原料制取Al2O3的流程如图:
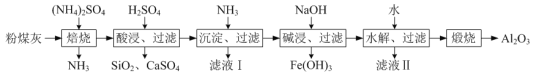
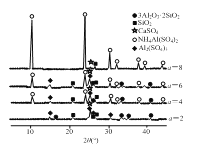
(1)当(NH4)2SO4和3Al2O3·2SiO2的配比a(a=![]() )不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
)不同时,“焙烧”后所得产物的X射线衍射谱图如图所示(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。由图可知,当a=___时,3Al2O3·2SiO2的利用率最高。
(2)“沉淀、过滤”所得滤渣为Fe(OH)3和Al(OH)3,生成Fe(OH)3的离子反应方程式为___。
(3)“碱浸”加入NaOH发生反应的离子方程式为___。
(4)“水解、过滤”可得到Al(OH)3沉淀,升高温度有利于水解的原因是___。该步骤可将加水改成通入过量的___气体。
(5)流程中,可以回收并循坏利用的物质除NH3外,还有___和___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A.标准状况下,2.24LH2O分子中共价键的数目为0.2NA
B.1molNa2O2与足量CO2充分反应,转移的电子数为2 NA
C.N2(g)+3H2(g)![]() 2NH3(g) △H=-92 kJ·mol-1,若放出92kJ能量,生成NH3 2NA
2NH3(g) △H=-92 kJ·mol-1,若放出92kJ能量,生成NH3 2NA
D.0.1molH2和0.1molI2于密闭容器中充分反应后,HI分子总数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,反应2NO+O2![]() 2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
2NO2(正反应为放热反应)达平衡时NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是()
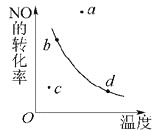
A.a点B.b点C.c点D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,固定容积的密闭容器中发生反应A(g)+3B(g)![]() 2C(g)+2D(s),下列叙述不是反应达到平衡状态标志的是( )
2C(g)+2D(s),下列叙述不是反应达到平衡状态标志的是( )
①2υ正(B)=3υ逆(C) ②单位时间内生成amol A,同时生成3amol B
③A、B、C的浓度不再变化 ④混合气体密度不随时间变化而变化
⑤混合气体的总压强不再变化 ⑥密闭容器中C的体积分数不变
⑦单位时间内消耗amol A,同时生成3amol B ⑧A、B、C、D的分子数之比为1∶3∶2∶2
A.②⑧B.②⑤⑧C.①③④⑦D.②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
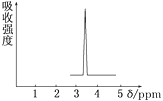
【题目】(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为______,请预测B的核磁共振氢谱上有________个峰(信号)。
(2)用系统命名法命名下列物质
①![]() ________________;②CH3CH2CH=CHCH3________________。
________________;②CH3CH2CH=CHCH3________________。
(3)写出结构简式或名称:
①分子式为C8H10的芳香烃,苯环上的一溴取代物只有一种,写出该芳香烃结构简式____________________。
②戊烷(C5H12)的某种同分异构体只有一种一氯代物,写出该戊烷的名称__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素.
(1)铁、钴、镍都是很好的配位化合物形成体.
①[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+。写出Co2+的价层电子排布图__.[Co(H2O)6]2+中Co2+的配位数为__。NH3分子的中心原子杂化方式为__,H2O分子的立体构型为__。
②铁、镍易与一氧化碳作用形成羰基配合物,如:Fe(CO)5,Ni(CO)4等.CO与N2属于等电子体,则CO分子中σ键和π键数目比为__,写出与CO互为等电子体的一种阴离子的离子符号__。
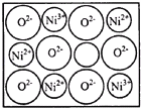
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价.NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO__FeO(选填“<”“>”“=”);某种天然NiO晶体存在如图所示缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代.其结果晶体仍呈电中性.某氧化镍样品组成为Ni0.97O.该晶体中Ni3+与Ni2+的离子数之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A.若![]() 为强碱,则
为强碱,则![]() 也为强碱
也为强碱
B.若![]() 为强酸,则Y是活泼非金属元素
为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为![]() ,则Z的最高正化合价为
,则Z的最高正化合价为![]()
D.若Ⅹ的最高正化合价为![]() ,则五种元素都是非金属元素
,则五种元素都是非金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图化合物是有机合成中一种常用的还原剂,其中X、Y、Z为原子序数依次增大的短周期主族元素,且X、Y、Z处于不同周期。下列叙述正确的是( )
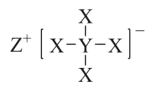
A.Y的最高价氧化物对应的水化物属于两性氢氧化物
B.原子半径:Z<Y<X
C.Z与X可形成离子化合物ZX
D.该化合物中X、Y、Z均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com