
| A、2 L 0.1 mol?L-1 K2SO4溶液中离子所带电荷总数约为0.6 NA |
| B、标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的原子总数均为2NA |
| C、1 mol Cl2变为Cl-时得到的电子数为NA |
| D、由质量守恒定律可知1mol的氯化铁能形成NA个氢氧化铁胶体粒子 |


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 |
| B、电池的正极反应式为:O2+2H2O+4e-═4OH- |
| C、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D、燃料电池中c(KOH)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
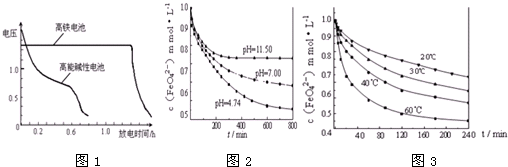
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条看不到明显现象;关闭B阀后,C处红布逐渐褪色.则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条看不到明显现象;关闭B阀后,C处红布逐渐褪色.则D瓶中装的是( )| A、浓H2SO4 |
| B、NaOH溶液 |
| C、H2O |
| D、Na2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解/Ksp:CaCO3<CaSO4 |
| B、用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成/该电极为阳极 |
| C、向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出/氧化性:Cu2+>Fe3+ |
| D、向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成/该溶液中一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、如图所示的是一个放热反应 |
| B、只有活化分子才能发生有效碰撞 |
| C、升高温度或加入催化剂,可以改变化学反应的反应热 |
| D、△H>0、△S<0的反应能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com