
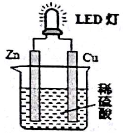
| A. | 如果将硫酸换成橙汁,导线中不会有电子流动 | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 锌是负极,电子从锌片经导线流向铜片 | |
| D. | 装置中存在化学能→电能→光能”的转换 |
分析 锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,正极发生还原反应生成氢气,据此解答该题.
解答 解:A.橙汁显酸性也能作电解质溶液,所以将硫酸换成橙汁,仍构成原电池,则导线中有电子流动,故A错误;
B.铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子被还原生成氢气,故B正确;
C.锌比铜活泼,形成原电池反应时,锌为负极,铜为正极,电子从负极锌片经导线流向正极铜片,故C正确;
D.原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故D正确;
故选A.
点评 本题考查了原电池的工作原理,明确正负极的判断方法以及能量的转化即可解答,可以从电子流向、电极上得失电子、电极上发生反应类型来判断正负极,难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
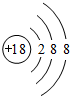
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
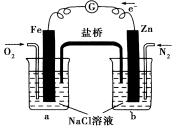
| A. | 烧杯b中发生还原反应 | |
| B. | 烧杯b中发生的反应为2Cl--2e-═Cl2↑ | |
| C. | 烧杯a中发生的反应为2H++2e-═H2↑ | |
| D. | 烧杯a中的溶液pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
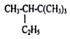 的系统命名为2,2,3,-三甲基戊烷;
的系统命名为2,2,3,-三甲基戊烷;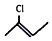 表示的分子式为C4H7Cl;
表示的分子式为C4H7Cl; .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
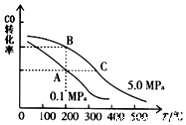 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com