


分析 根据流程,得到高铁酸钾,工业上常采用NaClO氧化法生产,原理为:向氢氧化钠中通入氯气,可以得到次氯酸钠溶液,调节pH,向其中加入硝酸铁,次氯酸钠可以将之氧化,3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O,过滤,即可得到高铁酸钠,向其中加入氢氧化钾,可以得到高铁酸钾,即Na2FeO4+2KOH=K2FeO4+2NaOH.
(1)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
(2)相同温度下,溶度积大的物质向溶度积小的物质转化;
(3)①寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面;
②从盐类的水解角度分析;根据反应物和生成物书写反应的离子方程式;
(4)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶.
解答 解:(1)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)相同温度下,溶度积大的物质向溶度积小的物质转化,所以Ksp(K2FeO4)<Ksp(Na2FeO4),故答案为:<;
(3)①寻找最佳温度要具备的条件:该温度下反应速率快,生成高铁酸钾的产率较大两方面,所以工业生产中最佳温度为26℃,因为在该温度下生成高铁酸钾的产率最大,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比$\frac{330}{275}$=1.2,即6:5,故答案为:26;6:5;
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,原因是NaClO水解呈碱性,Fe(NO3)3水解呈酸性,二者发生互促水解,反应的离子方程式为3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO,碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,反应的离子方程式为2FeO42-+Fe3++8OH-=3FeO43-+4H2O,故答案为:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO;2FeO42-+Fe3++8OH-=3FeO43-+4H2O;
(4)由题目信息可知,K2FeO4可溶于水,在中性或酸性溶液中能分解,在碱性溶液中稳定,在分离提提纯的时候就要在碱性环境中进行,要防止引入新杂质,所以需要将K2FeO4粗产品在稀KOH溶液中溶解,然后加入饱和KOH溶液,冷却结晶,过滤,故答案为:稀KOH溶液;饱和KOH溶液.
点评 考查考查物质的制备方案的设计、难溶电解质的溶解平衡,题目难度中等,解答本题时注意把握题给信息,学习中注重知识迁移能力的培养.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 仪器标号 | (1) | (2)(上) | (2)(下) | (3) | (4) | (5) |
| 试剂标号 | G | F |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
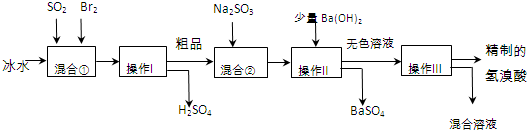
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
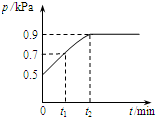 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | t1时n(X)=0.04 mol | |
| B. | t1到t2,混合气体的平均相对分子量增大 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N3-:1s22s22p3 | B. | F-:1s22s22p6 | ||
| C. | Fe2+:1s22s22p63s23p63d6 | D. | O2-:1s22s22p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com