
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5℃,100℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%、单宁酸(Ka约为104,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如下图所示。
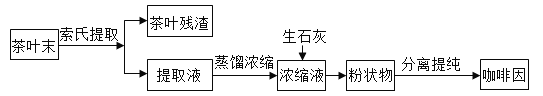
索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
(2)提取过程不可选用明火直接加热,原因是______________,与常规的萃取相比,采用索氏提取器的优点是______________。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是______________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是中和______________和吸收______________。
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
【答案】增加固液接触面积,提取充分 沸石 乙醇易挥发,易燃 使用溶剂少,可连续萃取(萃取效率高) 乙醇沸点低,易浓缩 AC 单宁酸 水 升华
【解析】
(1)萃取时将茶叶研细可以增加固液接触面积,从而使提取更充分;由于需要加热,为防止液体暴沸,加热前还要加入几粒沸石;
(2)由于乙醇易挥发,易燃烧,为防止温度过高使挥发出的乙醇燃烧,因此提取过程中不可选用明火直接加热;根据题干中的已知信息可判断与常规的萃取相比较,采用索式提取器的优点是使用溶剂量少,可连续萃取(萃取效率高);
(3)乙醇是有机溶剂,沸点低,因此与水相比较乙醇作为萃取剂的优点是乙醇沸点低,易浓缩;蒸馏浓缩时需要冷凝管,为防止液体残留在冷凝管中,应该选用直形冷凝管,而不需要球形冷凝管,A正确,B错误;为防止液体挥发,冷凝后得到的馏分需要有接收瓶接收馏分,而不需要烧杯,C正确,D错误,答案选AC。
(4)由于茶叶中还含有单宁酸,且单宁酸也易溶于水和乙醇,因此浓缩液中加入氧化钙的作用是中和单宁酸,同时也吸收水;
(5)根据已知信息可知咖啡因在100℃以上时开始升华,因此该分离提纯方法的名称是升华。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】NaClO2可用来漂白织物,其生产工艺如下图,回答下列问题:
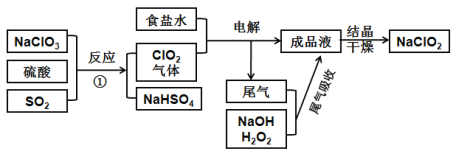
(1)图中两种氯的含氧酸盐中氯元素的化合价从高到低为____价、____价
(2)电解步骤所用食盐水由粗盐水精制而成,除去粗盐水中Mg2+、Ca2+,应加入的试剂分别为____、____
(3)写出反应①的化学方程式:__________
(4)“有效氯含量”是指每克含氯消毒剂的能力相当于多少克Cl2的氧化能力。则NaClO2的有效氯含量为:_______(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁--空气燃料电池工作原理示意图。下列有关该电池的说法不正确的是( )
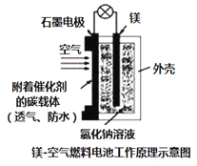
A.该电池Mg作负极,发生氧化反应
B.该电池的正极反应式为:![]()
C.电池工作时,电子通过导线由Mg电极流向C电极
D.当电路中通过0.2mol电子时,消耗的![]() 体积为1.12L
体积为1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X、Y、W、Q四种元素的原子最外层电子数之和为23。则下列说法中正确的是( )
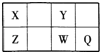
A. 钠与W形成的化合物Na2W2中既含离子键又含非极性共价键
B. 由Z与Y组成的物质在熔融时能导电
C. 氢化物的沸点:Y<Q
D. X有多种同素异形体,而Y不存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)金刚石、晶体硅、碳化硅,属于____晶体,其熔化时克服的微粒间的作用力是______。
(2)HF、HBr、HI形成的晶体,沸点由高到低的顺序为:_______________。
(3)NH3易液化,解释原因:_______,NH3分子的空间构型为____________。
(4)MgO的熔点比CaO的高,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。关于常温下pH=2的H2SO4溶液,溶液中不存在H2SO4分子,但存在HSO4一离子,下列说法错误的是
A.每升溶液中的H+数目为0.01NA
B.Na2SO4溶液中:c(Na+)=2c(SO42-)>c(H+)=2c(OH-)
C.向稀硫酸中逐滴滴加浓硫酸,溶液中![]() 减小
减小
D.NaHSO4不是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒精检测仪可帮助交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。反应原理为:CH3CH2OH+O2=CH3COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。下列说法正确的是( )

A.b为正极,电极反应式为:O2+2H2O+4e-=4OH-
B.电解质溶液中的H+移向呼气口
C.若有0.4mol电子转移,则在标准状况下消耗2.24L氧气
D.呼出气体中酒精含量越低,微处理器中通过的电流越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱土金属指元素周期表中第ⅡA族元素,它们的单质和化合物用途较为广泛。
(1)铍元素能形成一种价格昂贵的宝石——祖母绿,其化学式为Be3Al2(SiO3)6,其中铍元素的化合价是________,基态铍原子的价电子排布式为________。
(2)镁是航天工业的重要材料。镁元素和相邻元素钠、铝的第一电离能的大小顺序为________。
(3)钙元素在自然界以化合物CaCl2、CaCO3、CaSO4、Ca(OH)2等形式存在。上述四种物质中只含有一种类型化学键的是________;CO32-的中心原子的杂化类型是________,空间构型是________。

(4)钡元素与氧元素能够形成一种化合物,其晶胞结构如图所示,该物质的化学式为________,Ba2+的配位数是________,若阿伏加德罗常数的值为NA,晶胞边长为a cm,则晶体的密度为________g·cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com