
分析 电解质和非电解质都必须是化合物;电解质在熔融状态或水溶液中能导电的化合物,非电解质是在熔融状态和水溶液中都不能导电的化合物,金属单质能导电;电解质在熔融状态或水溶液中能导电;强电解质是指在水溶液中完全电离的化合物;能和碱反应生成盐和水的氧化物是酸性氧化物,据此即可解答.
解答 解:④⑧⑨⑩是在熔融状态或水溶液中能导电的化合物,属于电解质;④⑨⑩是在水溶液中完全电离的化合物,属于强电解质;②③⑤⑦是在熔融状态和水溶液中都不能导电的化合物,属于非电解质;能导电的是①⑥;⑤能和碱反应生成盐和水的氧化物,属于酸性氧化物.
故答案为:④⑧⑨⑩;④⑨⑩;②③⑤⑦;①⑥;⑤.
点评 本题考查了电解质与非电解质、物质的导电性判断,题目难度不大,注意明确电解质与非电解质的本质区别,明确溶液导电性原因是关键.


科目:高中化学 来源: 题型:选择题
| A. | HOCH2COOH既可以发生取代反应又可以发生缩聚反应 | |
| B. | 蔗糖、纤维素的水解过程都是高分子转化为小分子的过程 | |
| C. | 甲烷、甲醛、甲酸都不存在同分异构体,则甲醚(CH3OCH3)也无同分异构体 | |
| D. | 按系统命名法,化合物 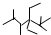 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | XOH物质的量浓度(mol•L-1) | 盐酸物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | b | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③⑤ | C. | ①④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3饱和溶液中滴加NaOH溶液形成红褐色的分散系 | |
| B. | 一支钢笔使用两种不同牌子的蓝黑墨水,易出现堵塞 | |
| C. | 在河水与海水的交界处,易有三角洲形成 | |
| D. | 水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
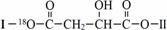 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.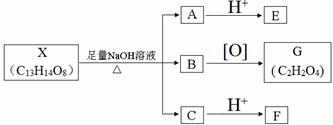
 .
.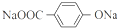 ;X的结构简式是
;X的结构简式是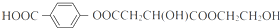 .
.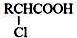 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH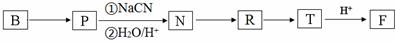
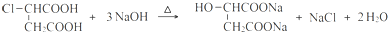 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

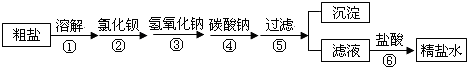
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、CCl4、酒精可用来萃取溴水中的溴 | |
| B. | 用激光笔鉴别Fe(OH)3胶体和FeCl3溶液 | |
| C. | 加入盐酸以除去硫酸钠中的少量碳酸钠杂质 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
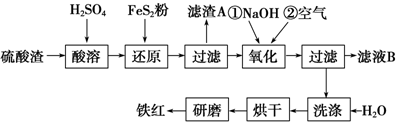
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com