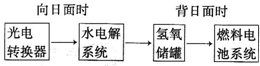
��ҵ������N
2��H
2���Ժϳ�NH
3��NH
3�ֿ��Խ�һ���Ʊ�������N
2H
4���ȣ�
��1���������N
2H
4��ȼ�ϣ�N
2O
4������������֪��
N
2��g��+2O
2��g���T2NO
2��g����H=67.7kJ?mol
-1 N
2H
4��g��+O
2��g���TN
2��g��+2H
2O��g����H=-534.0kJ?mol
-1 NO
2��g��?
N
2O
4��g����H=--26.35kJmol
-1��д����̬��������̬������������ȼ�����ɵ�������̬ˮ���Ȼ�ѧ����ʽ��
��
��2������--����ȼ�ϵ����һ�ּ���ȼ�ϵ�أ��������Һ��20%��30%���ⰱ������Һ���õ�طŵ�ʱ�������ĵ缫��ӦʽΪ
��
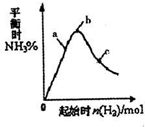
��3����300��ʱ���ı���ʼ��Ӧ�������������ʵ����Է�ӦN
2��g��+2H
2��g��?2NH
3��g����H��0��Ӱ����ͼ��ʾ��
������ͼ�л���400��ʱ��Ӧ��ͼ��
����a��b��c������H
2��ת������ߵ���
������ĸ����

 ��ҵ������N2��H2���Ժϳ�NH3��NH3�ֿ��Խ�һ���Ʊ�������N2H4���ȣ�
��ҵ������N2��H2���Ժϳ�NH3��NH3�ֿ��Խ�һ���Ʊ�������N2H4���ȣ�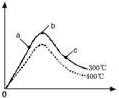 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�