
下列过程需加入还原剂才能实现的是
A. B.
B.
C.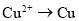 D.
D.
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源:2014-2015云南省高二上学期期末考试化学试卷(解析版) 题型:选择题
在一密闭容器中,反应aA(g) bB (g) 达到平衡后,保持温度不变,将容器体积增加一倍,达到新的平衡时B的浓度是原来的60%,则下列说法不正确的是
A、平衡向正反应方向移动了 B、物质A的转化率增大了
C、物质B的质量分数增加了 D、a>b
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省乐山市高一年级上学期期末考试化学试卷(解析版) 题型:选择题
把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
A.1∶1 B.2∶1 C.2∶3 D.3∶2
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省吉安市高一上学期期末考试化学试卷(解析版) 题型:实验题
(11分)科学探究结果的准确性有赖于探究方法的科学性。某课外活动小组用下图装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨反应的装置。
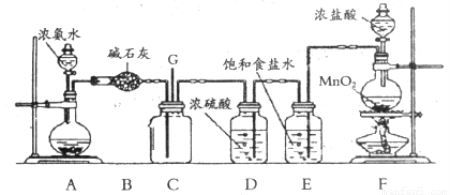
请回答下列问题:
(1)装置F中发生反应的化学方程式为_____________;浓盐酸在该反应中所表现出的性质为_____________、_____________。
(2)装置E的作用是:__________________________。
(3)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式__________________________。
(4)该活动小组中甲、乙两位同学按下图装置继续进行实验:
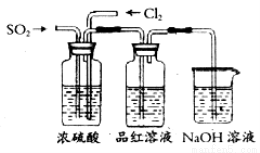
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:__________________________,其有关反应的离子方程式为__________________________。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?_______________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省吉安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列各组物质,按混合物、单质、化合物顺序排列正确的是
A.空气、臭氧、胆矾 B.碘酒、白磷、盐酸
C.干冰、氮气、冰 D.生石灰、液氧、大理石
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省吉安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列操作中,溶液的颜色不发生变化的是
A.氧化镁固体加入稀盐酸中,完全溶解
B.氢氧化铜加入到稀硫酸中
C.氯化铁溶液中加入足量铜粉,充分振荡
D.氯化铁溶液中滴加硫氰化钾(KSCN)溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:填空题
(10分)滴定实验是化学学科中重要的定量实验。请回答下列问题:
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250 mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
(1)用_____滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液。
(2)试样中NaOH的质量分数为______________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是________________。
Ⅲ.沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省泰州市姜堰区高一上学期期末化学试卷(解析版) 题型:填空题
(14分)结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的正确装置是 (填字母)。

将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为 。
漂白粉与浓盐酸发生氧化还原反应,离子方程式为 。
(3)某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
a.Cl2+2I-=2Cl-+I2
b.Cl2+2Fe2+=2Cl-+2Fe3+
c.5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示。

请回答下列问题:
①当n(Cl2)=0.12mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子及其
物质的量 (写出计算过程,否则不得分)。
②当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为 L(写出计算过程,否则不得分)。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省宿迁市高二下学期学业水平模拟化学试卷(解析版) 题型:选择题
用聚光手电筒照射下列分散系,不能观察到丁达尔效应的是
A.KOH溶液 B.Fe(OH)3胶体 C.淀粉溶液 D.蛋白质溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com