
【题目】草酸(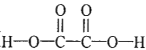 )在工业上可作漂白剂、鞣革剂,也是实验室常用试剂。
)在工业上可作漂白剂、鞣革剂,也是实验室常用试剂。
(1)已知草酸中相关化学键的键能数据如下表:

一定条件下发生反应H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g) △H=_________kJ/mol。
H2O(g)+CO(g)+CO2(g) △H=_________kJ/mol。
(2)现将0.50mol无水草酸放入10L的密闭容器中,分别在T1、T2时进行上述反应(体系内物质均为气态),测得n(H2C2O4)随时间变化的数据如下表:

①温度:T1_________T2(填“>”、“<”或“=”);
②T2时0~20min平均反应速率v(CO)= _________;
③该反应达到平衡的标志为_________ (填序号);
a消耗H2C2O4和生成H2O的物质的量相等 b.气体密度不变
c混合气体的平均摩尔质量不变 d.体系中![]() 不变
不变
④T2时,反应至20min时再加入0.5molH2C2O4,反应达平衡时H2C2O4物质的量_________0.36mol(填“>”“<”或“=”)。
(3)室温下利用H2C2O4溶液和酸性KMnO4溶液的反应探究外界条件对反应速率的影响,设计方案如下:

①上述反应的离子方程式为_________;
②分析数据可得到的结论是_________;
③该实验中若n(Mn2+)随时间变化趋势如图一所示,请于图二画出t2 后生成CO2的速率图像(从a点开始作图)并说明理由_________。
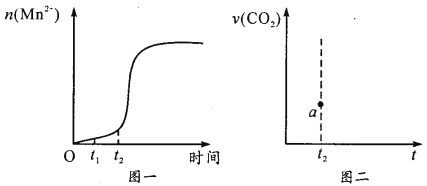 。
。
【答案】2a+c-b < 0.0016mol/(L·min) cd < 5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O 其他条件不变时,草酸的浓度越大,反应速率越快 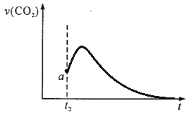 ,锰离子对反应起到催化作用,生成二氧化碳的速率会突然加快,随着反应的进行,溶液中溶质的浓度逐渐减小,生成二氧化碳的速率减慢,最后几乎为0
,锰离子对反应起到催化作用,生成二氧化碳的速率会突然加快,随着反应的进行,溶液中溶质的浓度逐渐减小,生成二氧化碳的速率减慢,最后几乎为0
【解析】
(1)根据△H=反应物的总键能-生成物的总键能计算;
(2)①温度越高,化学反应速率越快;②首先可以计算T2时0~20min平均反应速率v(H2C2O4),再结合方程式H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g),计算v(CO);③根据化学平衡状态的特征和标志分析判断;④根据表格数据,T2时,反应至20min时反应达到平衡,再加入0.5molH2C2O4,相当于增大压强,据此分析判断;
H2O(g)+CO(g)+CO2(g),计算v(CO);③根据化学平衡状态的特征和标志分析判断;④根据表格数据,T2时,反应至20min时反应达到平衡,再加入0.5molH2C2O4,相当于增大压强,据此分析判断;
(3)①反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,结合化合价升降守恒写出并配平反应的化学方程式;②表格中溶液的总体积相同,高锰酸钾的体积相等,草酸的体积不同,结合溶液褪色需要的时间分析解答;③根据n(Mn2+)随时间变化趋势图可知,t2 时反应速率突然加快,可能是生成的锰离子对反应起到催化作用,因此生成二氧化碳的速率也会突然加快,随着反应的进行,溶液中溶质的浓度逐渐减小,因此生成二氧化碳的速率减慢,最后几乎为0,据此分析解答。
(1)反应物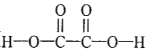 中含有2个H-O,2个C-O,2个C=O和1个C-C;生成物H2O+CO+CO2中含有2个H-O,1个
中含有2个H-O,2个C-O,2个C=O和1个C-C;生成物H2O+CO+CO2中含有2个H-O,1个![]() ,2个C=O,H2C2O4(g)
,2个C=O,H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g) △H=反应物的总键能-生成物的总键能=2E(C-O)+E(C-C)-E(
H2O(g)+CO(g)+CO2(g) △H=反应物的总键能-生成物的总键能=2E(C-O)+E(C-C)-E(![]() )=(2a+c-b)kJ/mol,故答案为:2a+c-b;
)=(2a+c-b)kJ/mol,故答案为:2a+c-b;
(2)①温度越高,化学反应速率越快,根据表格数据可知,相同时间内,n(H2C2O4)在T2时变化大,反应速率快,因此温度:T1<T2,故答案为:<;
②T2时0~20min平均反应速率v(H2C2O4)=![]() =0.0016mol/(L·min),故方程式H2C2O4(g)
=0.0016mol/(L·min),故方程式H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g),v(CO)= v(H2C2O4)= 0.0016mol/(L·min),故答案为:0.0016mol/(L·min);
H2O(g)+CO(g)+CO2(g),v(CO)= v(H2C2O4)= 0.0016mol/(L·min),故答案为:0.0016mol/(L·min);
③a. H2C2O4(g) ![]() H2O(g)+CO(g)+CO2(g),消耗H2C2O4和生成H2O的物质的量始终相等,不能说明达到平衡状态,错误;b.气体的质量不变,气体的体积不变,因此气体密度始终不变,不能说明达到平衡状态,错误;c.气体的质量不变,气体的物质的量是一个变量,当混合气体的平均摩尔质量不变,说明气体的物质的量不变,说明反应达到了平衡状态,正确;d.随着反应的进行,H2C2O4的物质的量减小,CO的物质的量增大,当体系中
H2O(g)+CO(g)+CO2(g),消耗H2C2O4和生成H2O的物质的量始终相等,不能说明达到平衡状态,错误;b.气体的质量不变,气体的体积不变,因此气体密度始终不变,不能说明达到平衡状态,错误;c.气体的质量不变,气体的物质的量是一个变量,当混合气体的平均摩尔质量不变,说明气体的物质的量不变,说明反应达到了平衡状态,正确;d.随着反应的进行,H2C2O4的物质的量减小,CO的物质的量增大,当体系中![]() 不变,说明正逆反应速率相等,达到了平衡状态,正确;故选cd;
不变,说明正逆反应速率相等,达到了平衡状态,正确;故选cd;
④根据表格数据,T2时,反应至20min时反应达到平衡,再加入0.5molH2C2O4,相当于增大压强,平衡逆向移动,反应达平衡时H2C2O4物质的量<0.36mol,
(3)①反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,改写成离子方程式为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O,故答案为:5H2C2O4+2MnO4-+6H+=2Mn2++10CO2+8H2O;
②表格中溶液的总体积相同,高锰酸钾的体积相等,草酸的体积不同,因此本实验探究了草酸的浓度对反应速率的影响,根据溶液褪色需要的时间可知,草酸的浓度越大,溶液褪色的时间越少,说明反应速率越快,故答案为:其他条件不变时,草酸的浓度越大,反应速率越快;
③根据n(Mn2+)随时间变化趋势图可知,t2 时反应速率突然加快,可能是生成的锰离子对反应起到催化作用,因此生成二氧化碳的速率也会突然加快,随着反应的进行,溶液中溶质的浓度逐渐减小,因此生成二氧化碳的速率减慢,最后几乎为0,因此生成CO2的速率图像为 ,故答案为:
,故答案为: ,锰离子对反应起到催化作用,生成二氧化碳的速率会突然加快,随着反应的进行,溶液中溶质的浓度逐渐减小,生成二氧化碳的速率减慢,最后几乎为0。
,锰离子对反应起到催化作用,生成二氧化碳的速率会突然加快,随着反应的进行,溶液中溶质的浓度逐渐减小,生成二氧化碳的速率减慢,最后几乎为0。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作所对应的现象、结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | SO2通入BaCl2溶液,然后滴入稀硝酸 | 产生白色沉淀,白色沉淀不溶于稀硝酸 | 所得沉淀为BaSO3,后转化为BaSO4 |
B | 向含有酚酞的Na2CO3溶液中加入BaCl2溶液 | 溶液颜色变浅 | Na2CO3溶液中水解平衡向右移动 |
C | 用pH试纸测定NaC1和NaF溶液的pH | pH(NaC1)<pH(NaF) | F元素非金属性强于C1 |
D | 向足量FeI2溶液中滴加2滴氯水,再分别滴加①淀粉溶液②KSCN溶液 | ①溶液变蓝 ②无明显现象 | 还原性:I->Fe2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要求完成下列问题。
(1)请根据图示回答:
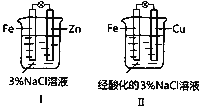
①在Ⅰ中,Zn为_____________极(填“正”或“负”)。
②在Ⅱ中,负极反应式为_____________;电子由________极移向_____________极(填“Fe”或“Cu”),溶液中Na+移向_____________极(填“Fe”或“Cu”)。
③在Ⅱ中,酸是足量的。若产生了标准状况下5.6 L的气体,则转移_________mol e-。
(2)铅蓄电池的总反应为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。该电池的负极材料是_________。(填化学式)
2PbSO4+2H2O。该电池的负极材料是_________。(填化学式)
(3)用32 g Cu与300 mL 12 mol/L的浓硝酸反应,当铜全部溶解后,共收集到标准状况下的气体11.2 L(不考虑NO2转化为N2O4),反应消耗的硝酸的物质的量是_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量且足量的两份锌a、b,分别加入等量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列各图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( )
A. 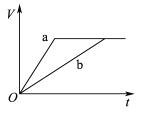 B.
B. 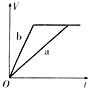
C. 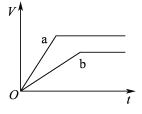 D.
D. 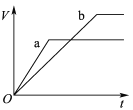
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,等物质的量的A和B发生反应:A(g)+2B(g) ![]() 2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
2C(g),反应达平衡时,若混合气体中A和B的物质的量之和与C的物质的量相等,则这时A的转化率为( )
A. 40% B. 50% C. 60% D. 70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-而进行下列五项操作,其中正确的操作顺序是( )
①过滤
②加过量NaOH溶液
③加适量盐酸
④加过量Na2CO3溶液
⑤加过量BaCl2溶液
A.①④②⑤③B.④①②⑤③C.⑤②①④③D.②⑤④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烷烃相对分子质量为86,如果分子中含有3个—CH3、2个—CH2—和1个![]() ,则该结构的烃的一氯取代物(不考虑立体异构)有 ( )
,则该结构的烃的一氯取代物(不考虑立体异构)有 ( )
A. 9种B. 6种C. 5种D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
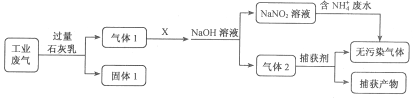
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+、B2+、C-、D2-4种离子具有相同的电子层结构。现有以下排列顺序:
①B2+>A+>C->D2-②C->D2->A+>B2+③B2+>A+>D2->C-④D2->C->A+>B2+4种离子的半径由大到小以及4种元素原子序数由大到小的顺序分别是( )
A.①④B.④①C.②③D.③②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com