
反应2C + O2=2CO 的能量变化如右图所示。含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是

A.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ 1
B.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ
C.该反应的热化学方程式是:2C(s) + O2(g)=2CO(g) ΔH=-110.5 kJ/mol
D.表示中和热的热化学方程式2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
科目:高中化学 来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷 题型:038
| |||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
现代炼锌的方法可分为火法和湿法两大类。火法炼锌是将闪锌矿(主要含ZnS)通过浮选、
焙烧使它转化为氧化锌,再把氧化锌和足量焦炭混合,在鼓风炉中加热至1373~1573K,使锌蒸馏出来。主要反应为:
焙烧炉中:2ZnS+3O2=2ZnO+2SO2 ①
鼓风炉中:2C+O2=2CO ②
ZnO (s)+CO (g) ![]() Zn (g)+CO2 (g) ③
Zn (g)+CO2 (g) ③
假设鼓风炉体积固定且密闭,随反应的进行鼓风炉内不同时间气态物质的物质的量浓度(mol/L)如下表
| 反应进行时间/min | CO | Zn | CO2 |
| 0 | 0.11 | 0 | 0 |
| 2 | 0.1 | 0.01 | 0.01 |
| 30 | c1 | c2 | c2 |
| 35 | c1 | c2 | c2 |
(1) 若保持温度不变,在鼓风炉中增大CO的浓度,K值 (填“增大”、“减小”或“不变”);
(2) 已知:该温度时,化学平衡常数K=1.0,则表中c1= (写出计算过程)
(3) 假设通过改变反应条件,若使焙烧炉中反应①的ZnO几乎完全被CO还原,焙烧炉和鼓风炉消耗的O2的体积比不超过 。
(4) 若起始浓度不变,通过改变反应条件,达平衡时鼓风炉中反应③CO的转化率为80%,此时该反应的平衡常数K= ,此时焙烧炉和鼓风炉消耗的O2的体积比大于
查看答案和解析>>
科目:高中化学 来源:2012-2013年海南琼海嘉积中学高二上高中教学质量监测理化学试卷(带解析) 题型:单选题
反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )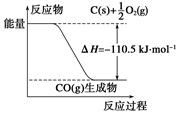
| A.12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ |
| B.该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ |
| C.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ |
| D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
查看答案和解析>>
科目:高中化学 来源:2014届海南琼海嘉积中学高二上高中教学质量监测理化学试卷(解析版) 题型:选择题
反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )
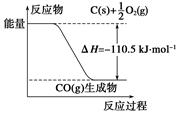
A.12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ
B.该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ
C.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差
查看答案和解析>>
科目:高中化学 来源:2010-2011学年天津市南开区高三一模考试(理综)化学部分 题型:填空题
(14分)能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ · mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ · mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)  CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
|
物 质 |
CO |
H2 |
CH3OH |
|
浓度/(mol·L-1) |
1.2 |
1.0 |
0.6 |
① 该反应的平衡常数表达式为:K=_____________________。
② 该时间内反应速率v(H2)=_________________。
③ 平衡时CO的转化率为_________________(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com