
| A. | 蒸发操作时,应使蒸发皿中的水分完全蒸干后,才能停止加热 | |
| B. | 加入盐酸,放出无色无味气体,该气体能使澄清石灰水变浑浊的气体,则原溶液中只含CO32- | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 除去铜粉中混有的少量镁粉和铝粉可加入足量氢氧化钠溶液,反应后过滤、洗涤 |
分析 A.蒸发时,当蒸发皿中出现大量固体时停止加热,避免造成固体飞溅;
B.原溶液中也可能存在HCO3-;
C.分液时应避免液体重新混合而污染;
D.铝粉能与氢氧化钠溶液反应,而镁不反应.
解答 解:A.蒸发时,不能直接蒸干,当有大量固体析出时可停止加热,用余热蒸干,防止蒸干后温度过高而导致固体分解,故A错误;
B.加入盐酸,放出无色无味气体,该气体能使澄清石灰水变浑浊的气体,该气体为二氧化碳,原溶液中可能存在HCO3-,故B错误;
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,可避免液体重新混合而污染,故C正确;
D.镁粉不与氢氧化钠溶液反应、但铝粉能与氢氧化钠溶液反应、反应时能把杂质除去,而且原物质也保留,故C错误;
故选C.
点评 本题考查化学实验方案的评价,题目难度不大,涉及物质的检验、分离等操作,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及实验方案的评价原则.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:实验题
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水,乙醇 | 可溶于水,乙醇,三氯乙醛 | 微溶于水,可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+534 kJ•L-1 | |
| B. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-53.4 kJ•L-1 | |
| C. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=+53.4 kJ•L-1 | |
| D. | N2H4(g)+2O2(g)═N2(g)+2H2O(g);△H=-534 kJ•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

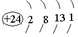 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.
与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图1所示,该晶胞中含有金属原子的数目为4.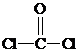 ,其中碳氧原子之间共价键是c(填序号)
,其中碳氧原子之间共价键是c(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、NO3-、HCO3- | B. | Na+、Fe3+、Cl-、SCN- | ||
| C. | Na+、Al3+、NO3-、Cl- | D. | K+、Cu2+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
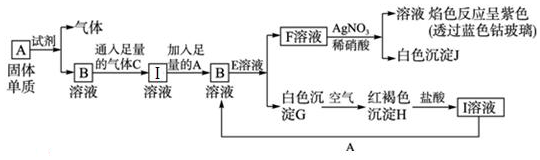
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水发生加成反应而使溴水褪色 | |
| B. | 苯与溴水发生取代反应而使溴水褪色 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 苯与浓硝酸、浓硫酸的混合物发生的反应不是取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com