
| ||
| 400℃ |



科目:高中化学 来源: 题型:
A、 |
B、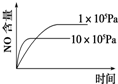 |
C、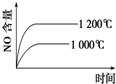 |
D、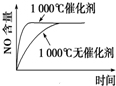 |
查看答案和解析>>
科目:高中化学 来源: 题型:
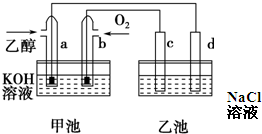
| A、甲池中,b电极是负极 |
| B、a电极的电极反应式C2H5OH+16OH--12e-=2CO32-+11H2O |
| C、一段时间后,用湿润淀粉KI试纸靠近乙池d电极变蓝放电 |
| D、乙池在反应前后溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比是2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、NF3在潮湿的空气中泄漏会产生红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ/mol |
| B、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ/mol |
| C、CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ/mol |
| D、CO2(g)+2NaOH(l)═2 NaHCO3(l)△H=-(8x-2y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3是氧化剂,H2O是还原剂 |
| B、还原剂和氧化剂的物质的量之比为2:1 |
| C、若生成0.2mol HNO3,则转移0.4mol电子 |
| D、按照树状分类法的分类原则,NF3属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO的摩尔质量是28 g |
| B、常温常压下,1 mol N2的体积是22.4 L |
| C、18gH2O含有的氢原子总数为2×6.02×1023 |
| D、0.1 mol/L Na2SO4溶液中,Na+的物质的量浓度为 0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水常温下呈液态,冰浮在水上,均与氢键有关 | ||||
| B、用于航天工业的氢氧燃料电池的电解质,使用H2SO4的效果比KOH好 | ||||
| C、SO2、氮氧化物和可吸处颗粒物是造成雾霾的一个重要原因 | ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com