
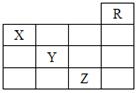
| A.①②③④ | B.①②③ | C.只有①④ | D.只有③ |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
| A.38Sr是第3周期ⅡA族元素 |
| B.Sr的离子半径比Kr(氪)的原子半径大 |
| C.Sr的碳酸盐受热会分解 |
| D.Sr的氧化物对应水化物碱性比Rb的氧化物对应水化物碱性弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.37 |
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 |
| -2 | | | -3 | -1 | | -3 | | -2 | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.非金属性:F>Cl>S | B.熔点: SiO2>KCl>I2 |
| C.稳定性:HF>H2S>H2O | D.碱性:KOH>NaOH>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.131 53I是碘的一种同素异形体 |
| B.131 53I是一种新发现的元素 |
| C.131 53I位于元素周期表中第4周期ⅦA族 |
| D.131 53I核内的中子数与核外电子数之差为25 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第三电子层上有4个电子 | B.最高正价为+2 |
| C.最高正价为+4 | D.第二电子层没有未成对电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稳定性H2S>HCl>HBr>HI | B.酸性HF>HCl>HBr>HI |
| C.离子半径K+>Cl->S2->S | D.酸性HClO4 >H2SO4>H2CO3>HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com