
分析 (1)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量;
(2)当反应物的能量低于生成物的能量时,反应是吸热的;
(3)固体煤经处理变为气体燃料后,根据气体燃料具有的优点分析.
解答 解:(1)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样,
故答案为:等于;
(2)制水煤气 C(s)+H2O(g)=CO(g)+H2(g)△H2>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量,反应物就需要吸收能量才能转化为生成物,反应条件是高温,
故答案为:小于;吸收;高温;
(3)煤通过途径Ⅱ作为燃料的意义是固体煤经处理变为气体燃料后,不仅在燃烧时可以大大减少SO2和烟尘对大气造成的污染,而且燃烧效率高,也便于输送,
故答案为:燃料燃烧充分,利用率高,放热多,污染小等.
点评 本题考查反应热与焓变的应用,题目难度中等,理解盖斯定律是解题的关键,注意掌握化学反应与能量变化的关系,试题培养了学生的灵活应用能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
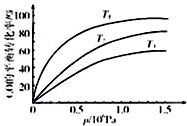 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
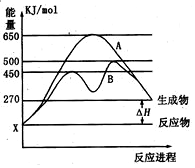 (1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1
(1)已知:Fe(s)+$\frac{1}{2}$O2(g)=FeO(s),△H=-272.0KJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
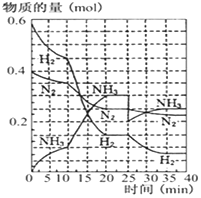 德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.
德国人发明了合成氨反应,其原理为:N2(g)+3H2(g)?2NH3(g);已知298K时,△H=-92.4kJ•mol-1,在500℃,20Mpa时,将氮气和氢气通入到体积为2升的密闭容器中,反应过程中各种物质的量变化如右图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
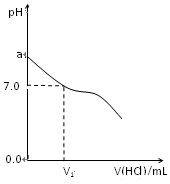 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的PH值的变化关系如图所示.
常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸.溶液的PH值的变化关系如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸均能与 Na 反应放出 H2,二者分子中官能团相同 | |
| B. | 乙烯和苯都能与 H2 发生加成反应,说明二者均含有碳碳双键 | |
| C. | 苯可以在空气中燃烧,但不能被酸性高锰酸钾溶液氧化 | |
| D. | 乙醇在铜催化作用下,能发生还原反应生成乙醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com