
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | 1H与D互称同位素 | |
| C. | H2O与D2O互称同素异形体 | |
| D. | 氘(D)原子核外有2个电子 |
分析 A.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20;
B.有相同质子数,不同中子数的原子或同一元素的不同核素互为同位素;
C.相同元素组成,不同形态的单质互为同素异形体;
D.氘(D)原子的质子数是1个,质子数=核外电子数.
解答 解:A.1H218O的相对分子质量为:1×2+18=20,D216O的相对分子质量为:2×2+16=20,两者相对分子质量相同,故A正确;
B.1H与D质子数相同,中子数不同,故互为同位素,故B正确;
C.H2O与D2O都是化合物,不是单质,不是同素异形体,故C错误;
D.质子数=核外电子数,氘(D)原子的质子数是1个,所以原子核外有1个电子,故D错误;
故选CD.
点评 本题考查同位素、同素异形体的概念,相对分子质量的计算,题目难度不大,注意对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 图乙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积 | |
| C. | 图丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数以ω(B)>ω(A) | |
| D. | 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
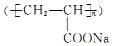 和苯甲酸异丙酯流程如下(部分条件已经略去):
和苯甲酸异丙酯流程如下(部分条件已经略去):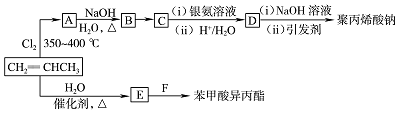
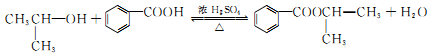 .
.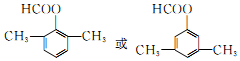 .
.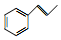 和F为原料(无机试剂任选),设计制备有机物
和F为原料(无机试剂任选),设计制备有机物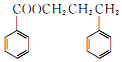 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量H2S:H+、Fe2+、Al3+、SO42- | |
| B. | 通入过量氨气:NH4+、A1O2-、OH-、SO42- | |
| C. | 加入过量NaC1O溶液:Fe3+、Na+、ClO-、SO42- | |
| D. | 加入过量NaOH溶液:Na+、A1O2-、OH-、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
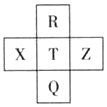 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | T的单质在化学反应中只表现氧化性 | |
| B. | R与Q的电子数相差16 | |
| C. | T形成的含氧酸的酸性一定比X形成的含氧酸强 | |
| D. | 在这五种元素中Z的化学性质最稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com