
| A�� | ;���ٷ�Ӧ��������Ũ�����ǿ�����Ժ����� | |
| B�� | ;���ڵĵڶ�����Ӧ��ʵ�������п���ͨ������O2Ũ������߲��� | |
| C�� | ��;���ٺ͢ڷֱ���ȡ1mol H2SO4�������ϸ�����1mol S����ת��6mol���� | |
| D�� | ;������;������ȸ������֡���ɫ��ѧ���������Ϊ;���ڱ�;������Ⱦ���С��ԭ�������ʸ� |
���� A��S��Ũ���ᷴӦ�������ᡢ����������ˮ�����������ԣ�
B������һ�ַ�Ӧ���Ũ�ȣ����������һ�ַ�Ӧ���ת���ʣ�
C������SԪ�صĻ��ϼ۱仯������
D��;�����и����������Ⱦ��
��� �⣺A��S��Ũ���ᷴӦ�������ᡢ����������ˮ���÷�Ӧ��ֻ������Ũ�����ǿ�����ԣ����������ԣ���A����
B������һ�ַ�Ӧ���Ũ�ȣ����������һ�ַ�Ӧ���ת���ʣ�����;���ڵĵڶ�����Ӧ��ʵ�������п���ͨ������O2Ũ������߶��������ת���ʣ���B��ȷ��
C��;���ٺ͢ڶ�����S���Ʊ�H2SO4��S�Ļ��ϼ۴�0�����ߵ�+6�ۣ���ȡ1 mol H2SO4�������ϸ�����1 mol S����ת��6 mol e-����C��ȷ��
D��;����S��Ũ���ᷴӦ�������ᡢ����������ˮ���и�����������������Ҷ�����������Ⱦ����������;������;������ȸ������֡���ɫ��ѧ���������D��ȷ��
��ѡA��
���� ���⿼�������ʵ��Ʊ�������ơ����ʵ����ʼ�������ԭ��Ӧ�����շ����ķ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ���ע�����ۼ����л��ϼ���ת�Ƶ��ӵĹ�ϵ����Ŀ�Ѷ��еȣ�


 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | Cu��OH��2 | Fe��OH��3 |
| Ksp | 2.2��10-20 | 2.6��10-39 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 7.8 g Na2O2��������ʪ��CO2��Ӧ��ת�Ƶĵ�����Ϊ0.1 NA | |
| B�� | ��״����2.24 L HCHO�к�0.4 NA��ԭ�� | |
| C�� | 23.4g NaCl�����к�0.1 NA����ͼ��ʾ�ṹ��Ԫ | |
| D�� | 4.0gSiC�����к��еĹ��ۼ���ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һ��ϡ���ᷴӦ��Ba2++SO42-�TBaSO4�� | |
| B�� | ̼��ƺʹ��ᷴӦ��CaCO3+2H+�TCa2++H2O+CO2�� | |
| C�� | AlCl3��Һ�м������ϡ��ˮ��Al3++4 NH3•H2O�TAlO2-+4NH4++2 H2O | |
| D�� | ������Ca��OH��2��NaHCO3��Ӧ��Ca2++2OH-+2HCO3-�TCaCO3��+H2O+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
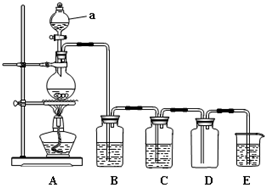 ��ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ���ش��������⣺
��ͼ��ʵ�������Ʊ��������֤�������ʵ�װ��ͼ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
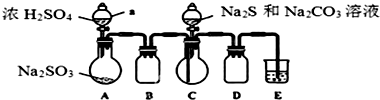
| ʵ�鲽�� | Ԥ���������� |
| ����1��ȡ����������Ʒ������������ˮ�� | ������ȫ�ܽ����ɫ������Һ |
| ����2������������� | |
| ����3�����ú�ȡ����Һ������BaCl2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH��Һ��Ba��OH��2������K2SO4��Һ | B�� | NaCl��Һ��Na2SO4������Ba��NO3��2��Һ | ||
| C�� | KOH��ҺK2CO3����CaCl2��Һ | D�� | HNO3��Һ��HCl������AgNO3��Һ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com