
| A. | W-的离子半径大于Z3+的离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的稳定性比X的强 |
分析 短周期主族元素X、Z、Y、W的原子序数依次增大,其中X、Y同主族,Y的单质是一种良好的半导体材料,则X为C元素、Y为Si;Z元素原子最外层电子数等于其电子层数,原子序数大于碳,只能处于第三周期,故Z为Al;W原子序数大于Si,处于第三周期,W是同周期中原子半径最小的元素,故W为Cl.
解答 解:短周期主族元素X、Z、Y、W的原子序数依次增大,其中X、Y同主族,Y的单质是一种良好的半导体材料,则X为C元素、Y为Si;Z元素原子最外层电子数等于其电子层数,原子序数大于碳,只能处于第三周期,故Z为Al;W原子序数大于Si,处于第三周期,W是同周期中原子半径最小的元素,故W为Cl.
A.Cl-离子比Al3+离子多一个电子层,故离子半径:Cl->Al3+,故A正确;
B.W、X形成的化合物为CCl4,属于共价化合物,故B错误;
C.X、W的最高价氧化物对应的水化物分别为碳酸、高氯酸,碳酸的酸性比高氯酸弱,故C错误;
D.非金属性X(C)>Y(Si),故Y的气态简单氢化物的稳定性比X的弱,故D错误,
故选A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意对元素周期律的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
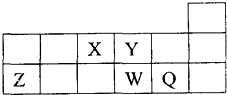
| A. | 离子Y2一和Z3+的核外电子数和核内质子数都相同 | |
| B. | 原子半径的大小顺序为:r(Z)>r(W)>r(Q)>r(Y)>r(X) | |
| C. | 最高价氧化物对应的水化物的酸性:W>Q | |
| D. | 元素X与元素Z的最高正化合价数值之和等于8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
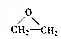 称为环氧乙烷,它在一定条件下,能与氢氧化物发生加成反应,氢原子加到氧原子上,其他部分加在碳原子上,下列对环氧乙烷的衍生物
称为环氧乙烷,它在一定条件下,能与氢氧化物发生加成反应,氢原子加到氧原子上,其他部分加在碳原子上,下列对环氧乙烷的衍生物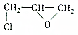 的叙述正确的是( )
的叙述正确的是( )| A. | 能与水反应生成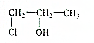 | |
| B. | 能碱性水解生成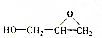 | |
| C. | 在一定条件下可以合成甘油 | |
| D. | 加入AgNO3溶液能生成难溶于硝酸的白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸能够使紫色石蕊试剂变红,所以乙酸是强酸 | |
| B. | 食醋除去水垢的现象证明了酸性:乙酸>碳酸 | |
| C. | 乙酸与乙醇发生的酯化反应不属于取代反应 | |
| D. | 在制备乙酸乙酯的实验中,用18O标记乙醇,在产物乙酸乙酯中检测不到18O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL含9.5g MgCl2的溶液 | |
| B. | 31g Na2O溶于水配成1L溶液 | |
| C. | 4%的H2SO4溶液(ρ=1.025g•cm-3) | |
| D. | 213mL 0.5mol•L-1盐酸和82mL 0.5mol•L-1盐酸的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L己烷中含有分子的数目为0.5NA | |
| B. | 1mol/L CH3COOH溶液中含有CH3COOH分子的数目为NA | |
| C. | 78g 苯中含有碳碳双键的数目为3NA | |
| D. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红色 | B. | 紫色 | ||
| C. | 蓝色 | D. | 视溶液的酸碱性待定H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com