
【题目】25℃时,在PbI2饱和溶液中存在平衡:PbI2(s)![]() Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是( )
Pb2+(aq)+2I-(aq),向其中加入KI固体,下列说法正确的是( )
A.溶液中Pb2+和I-浓度都增大
B.溶度积常数Ksp增大
C.沉淀溶解平衡向逆向移动
D.PbI2的溶解度不变
【答案】C
【解析】
含有大量PbI2的饱和溶液中存在着平衡PbI2(s)Pb2+(aq)+2I-(aq),加入KI溶液,c(I-)增大,沉淀溶解平衡逆移,c(Pb2+)减小,溶度积常数Ksp只与温度有关。
A. 含有大量PbI2的饱和溶液中存在着平衡PbI2(s)Pb2+(aq)+2I(aq),加入KI溶液,c(I)增大,沉淀溶解平衡逆移,c(Pb2+)减小,故A错误;
B. 溶度积常数Ksp只与温度有关,改变c(I),Ksp不变,故B错误;
C. 含有大量PbI2的饱和溶液中存在着平衡PbI2(s)Pb2+(aq)+2I-(aq),加入KI溶液,c(I)增大,沉淀溶解平衡逆移,故C正确;
D. 加入KI溶液,c(I)增大,沉淀溶解平衡逆移,c(Pb2+)减小,PbI2的溶解度减小,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取150mLO2所需的时间(秒)
| 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①该研究小组在设计方案时。考虑了浓度、___________、____________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________________。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%(密度为1.0g/cm3)的双氧水中,并用带火星的木条测试。测定结果如下:
实验 序号 | 催化剂(MnO2) | 操作 情况 | 观察结果 | 反应完成 所需的时间 |
A | 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 5span>分钟 |
B | 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
① 写出H2O2发生分解的化学反应方程式________________。求出实验A中H2O2在5分钟内的平均反应速率________________。(结果保留小数点后两位数字)
② 实验结果说明催化剂作用的大小与____________________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如图:下列叙述正确的是( )
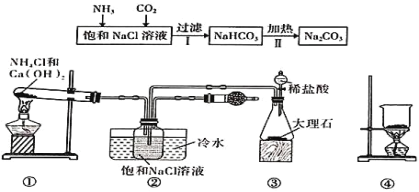
A.实验时先打开装置③中分液漏斗的旋塞,过一段时间后再点燃装置①的酒精灯
B.装置②的干燥管中可盛放碱石灰,作用是吸收多余的NH3
C.向步骤 I 所得滤液中通入氨气,加入细小的食盐颗粒并降温可析出NH4Cl
D.用装置④可实现步骤Ⅱ的转化,所得CO2可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.醋酸与氢氧化钠溶液反应:H++OH-=H2O
B.碳酸氢钠水解的离子方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
C.水溶液中NaHSO3的电离方程式:NaHSO3=Na++H++SO32-
D.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LCH3COOH溶液中逐渐加入NaOH固体,恢复至原温度后溶液中的关系如图所示(忽略溶液体积变化)。下列有关叙述不正确的是( )

A.CH3COOH的Ka=1.0×10-4.7
B.C点的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.B点的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-)
D.A点的溶液中:c(CH3COO-)+c(H+)+c(CH3COOH)-c(OH-)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们日常生活中的吃、穿、住、行、医关系密切:
(1)油脂、淀粉、蛋白质是我们食物中提供能量的主要物质,在人体内都能发生水解。
①油脂在酸性条件下水解的最终产物是_________和_________;
②上述三种物质不属高分子化合物的是_________,若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量水解实验的溶液加入_________(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量水解溶液加入几滴________,应观察到出现蓝色;
③蛋白质在人体内水解的最终产物是氨基酸.写出氨基酸共同含有的官能团的结构简式分别为_________和﹣COOH;
(2)现在越来越多的自行车采用铝合金作材料,它不仅轻便美观,而且也很耐久.它能长期使用的原因是_________,橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施使其分子转变为_________分子结构可增大强度和弹性;
(3)聚丙烯腈﹣合成腈纶又称人造羊毛,丙烯腈为CH2=CHCN,请写出聚丙烯腈的结构简式_________,生活中除常用的氯系消毒剂外,过氧乙酸是另一种常见消毒剂,主要是因为其结构中含有_________而表现出强氧化性;
(4)_________形成的合金被称为“亲生物金属”,广泛作为人造骨的材料.为防止工业生产过程产生的悬浮颗粒物进入大气,可以将混有悬浮颗粒物的气体通过沉降进行处理;
(5)居室装修所用的有些石材会释放出一种放射性物质,长期接触可能引起癌症,免疫功能异常,该放射性物质主要是_________(填写该物质的名称);
(6)氢氧化铝、碳酸镁都可用于治疗胃酸过多引起的不适,请分别写出相关反应的离子方程式:①_________②_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述,正确的是( )
A. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
B. 由N2O4(g)![]() 2NO2(g) ΔH=-56.9 kJ·mol-1,可知将1 mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9 kJ
2NO2(g) ΔH=-56.9 kJ·mol-1,可知将1 mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9 kJ
C. 由:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
D. 已知101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1,则1 mol碳完全燃烧放出的热量大于110.5 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com