
| A. | CH3CH(OH)COOH | B. | HO(CH2)2CHO | C. | HOOC-COOH | D. | CH3CH2COOH |
分析 有机物与足量的Na2CO3反应,可得到气体VbL,说明有机物中含有-COOH,等质量的某有机物和足量的金属钠反应,可得到气体VaL,且同温同压下Va>Vb,说明有机物还含有-OH,结合选项进行判断.
解答 解:有机物和的钠反应生成气体VaL为氢气体积,说明至少含有-OH、-COOH中的一种,该有机物与Na2CO3溶液反应生成气体VbL为二氧化碳体积,说明该有机物含有-COOH,同温同压下Va>Vb,根据2-OH~H2↑、2-COOH~H2↑、2-COOH~CO2↑,可知有机物还含有-OH,选项中只有A中CH3CH(OH)COOH含有-OH、-COOH,故选:A.
点评 本题考查有机物的推断,题目难度不大,注意-COOH可与碳酸钠反应生成气体,而-OH不与碳酸钠反应,若将碳酸钠改为碳酸氢钠,应满足羟基数目大于羧基数目,可以利用验证法判断.


科目:高中化学 来源: 题型:选择题
| A. | KSCN溶液、KCl溶液 | B. | NaOH溶液、NaCl溶液 | ||
| C. | 稀盐酸、稀硝酸 | D. | AgNO3溶液、稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.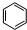 +3H2$→_{△}^{Ni}$
+3H2$→_{△}^{Ni}$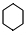 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
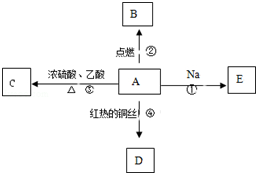 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
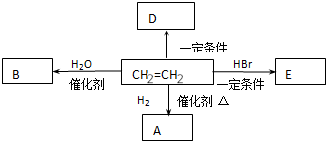
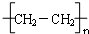 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | C. | Na、K、Rb | D. | SiC、NaCl、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.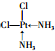 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲醇 | -97.8℃ | 64.8℃ | 0.791g•mL-1 | 易溶于水、乙醇、正丙醇 |
| 正丙醇 | -126.5℃ | 97.4℃ | 0.804g•mL-1 | 能跟水、甲醇、乙醇以任意比互溶 |
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com