
| A. | C2H6 | B. | C3H4 | C. | C6H6 | D. | C2H4 |
分析 相同质量的各烃完全燃烧,耗氧量取决于H元素的质量分数,分子中H元素的质量分数越高,耗氧量越大,计算分子中C原子与H原子数目之比,相同C原子,H原子数目越大,H元素质量分数越大,据此解答.
解答 解:等质量的烃燃烧,耗氧量取决于H%,H%越大耗氧量越大,
A.C2H6中N(C):N(H)=2:6=1:3;
B.C3H4中N(C):N(H)=3:4;
C.C6H6中N(C):N(H)=6:6=1:1;
D.C2H4中N(C):N(H)=1:2;
故C2H6中H的质量分数最大,相同质量C2H6的耗氧量最大,
故选A.
点评 本题考查烃燃烧耗氧量的判断,难度不大,注意根据相同质量的C、H消耗氧气的质量确定H的质量分数越大,耗氧量越大,注意对规律的理解掌握.


科目:高中化学 来源: 题型:填空题
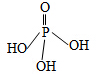 (1)三聚磷酸可视为三个磷酸分子(磷酸的结构如图)之间脱去两个分子的产物,其结构式为
(1)三聚磷酸可视为三个磷酸分子(磷酸的结构如图)之间脱去两个分子的产物,其结构式为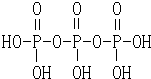 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
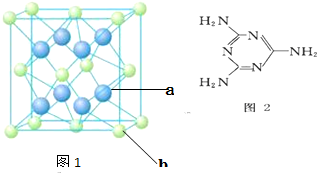 X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:
X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题: ,P元素属于ds区元素.
,P元素属于ds区元素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
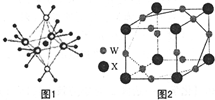 现有A、X、Y、Z、W五种元素,它们的原子序数依次增大.A原子的核外总数与其周期数相同;X基态原子的L电子层中有3个未成对电子;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;Z基态原子的3p轨道上得到两个电子后不能再容纳外来电子;W基态原子的最外层电子数为1,其余各电子层均充电子层均充满电子.请回答下列问题:
现有A、X、Y、Z、W五种元素,它们的原子序数依次增大.A原子的核外总数与其周期数相同;X基态原子的L电子层中有3个未成对电子;Y基态原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;Z基态原子的3p轨道上得到两个电子后不能再容纳外来电子;W基态原子的最外层电子数为1,其余各电子层均充电子层均充满电子.请回答下列问题: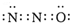 ,其中心原子的杂化轨道类型是sp,1molX2Y含有的π键数目为2NA.
,其中心原子的杂化轨道类型是sp,1molX2Y含有的π键数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
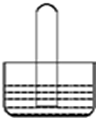
| A. | 若水槽中是水,试管中是NO2,可看到液面上升并且气体颜色逐渐变浅 | |
| B. | 若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去 | |
| C. | 若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色 | |
| D. | 若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入盐酸溶液 HCl+NH3═NH4Cl | |
| B. | 澄清的石灰水跟盐酸反应 H++OH-═H2O | |
| C. | 碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 金属钠跟水反应 Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
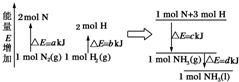 化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,(注:图中△E都为正值),写出该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.
化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,(注:图中△E都为正值),写出该反应的热化学方程式:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ•mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2molL的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com