


科目:高中化学 来源: 题型:
| A、液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积 |
| B、相同温度下,0.2mol?L-1醋酸溶液和0.1mol?L-1醋酸溶液中的c(H+) |
| C、在0.1mol?L-1NaHSO4溶液中,阳离子数与阴离子数 |
| D、在FeCl2溶液中,c(Cl-)与c(Fe2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀,若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | |||
| B | C |
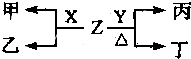
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | A | B | C | D |
| Y | CO2 | Fe2O3 | C2H5OH | FeCl3 |
| W | MgO | Al2O3 | C2H5ONa | CuCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大 | B、减少 |
| C、不变 | D、可能增大也可能减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.
373K时,某1L恒容密闭容器中加入1molNH3,发生如下可逆反应2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| c1 |
| c2 |
| A、1 |
| B、104 |
| C、10-4 |
| D、10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列关于1S电子在原子核外出现的概率分布图,也称电子云示意图(如图所示)的有关说法中,正确的是( )
下列关于1S电子在原子核外出现的概率分布图,也称电子云示意图(如图所示)的有关说法中,正确的是( )| A、通常用小黑点来表示电子的多少, |
| B、小黑点密度大,说明在该核外空间电子数目多 |
| C、通常用小黑点来表示电子绕核作高速圆周运动 |
| D、小黑点密,表示在该核外空间的单位体积内电子出现的机会大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com