
【题目】环境监察局常用“定电位NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A.“对电极”是负极
B.“工作电极”上发生的电极反应为NO2+2e-+2H+=NO+H2O
C.传感器工作时H+移向“对电极”
D.“对电极”的材料可能为活泼金属锌
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用 Na2SiO3 溶液制备硅酸。某小组同学进行了如下实验:
编号 | Ⅰ | Ⅱ |
实验 |
|
|
现象 | a 中产生凝胶状沉淀 | b 中凝胶状沉淀溶解,c 中无明显变化 |
下列结论不正确的是
A.Na2SiO3 溶液一定显碱性
B.由 Ⅰ 不 能 说 明 酸 性 H2CO3>H2SiO3
C.由Ⅱ可知,同浓度时 Na2CO3 溶液的碱性强于 NaHCO3 溶液
D.向 Na2SiO3 溶液中通入过量 CO2,发生反应:SiO32-+CO2+H2O=CO32-+H2SiO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用钌(Ru)基催化剂催化CO2(g)和H2(g)的反应时,每生成92g液态HCOOH放出62.4kJ的热量,下列说法正确的是( )

A.图示中物质II为该反应的催化剂
B.图示中参与循环的物质只有CO2和H2
C.反应的活化能为62.4kJ·mol-1
D.该反应的热化学方程式为H2(g)+CO2(g)=HCOOH(l) △H=-31.2kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验在学科中有着非常重要的作用,结合图示实验装置,下列相关分析的描述不正确的是( )
A.图1:盐桥中使用KCl溶液,电子的流向是Zn→G→Cu→CuSO4溶液→盐桥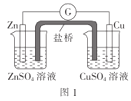
B.图2:可根据该实验验证铁的吸氧腐蚀
C.图3:在强酸和强碱的中和热实验中,强碱的浓度比强酸的略大
D.图4:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)可以判断反应2NO2(g)![]() N2O4(g)是一个放热反应
N2O4(g)是一个放热反应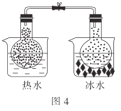
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴、铜及其化合物用途非常广泛。回答下列问题:
(1)基态Br原子核外电子排布式为[Ar]___。
(2)已知反应:Cu(BF4)2.6H2O+Cu+8CH3CN=2[Cu(CH3CN)4]BF4+6H2O。
①配合物[Cu(CH3CN)4]BF4中,与铜形成配位键的原子是___,BF4-的空间构型是___,与BF4-互为等电子体的分子有___(任写一种)。
②CH3CN分子中碳原子的杂化方式是___;1个CH3CN分子中含有___个σ键。
(3)电子亲合能与电离能相对应,元素的气态基态原子获得一个电子成为气态一价负离子所释放的能量称为该元素的第一电子亲合能,其大小主要取决于原子的有效核电荷、原子半径和原子的电子构型等因素。Br与F、Cl位于同一主族,第一电子亲合能(如图1所示)原比氯和溴都小,其原因是___。
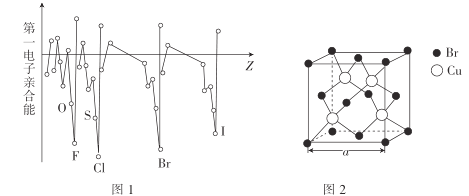
(4)溴化亚铜(晶胞结构如图2所示)可用作有机合成的催化剂,密度为4.71g·cm-3。
①晶胞中Br-的配位数为___。
②晶胞参数a=___(列出表达式即可)nm。(设NA为阿伏加德罗常数的数值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由多元素组成的化合物Fe-Sm-As-F-O是一种重要的铁系超导材料。下列说法正确的是
A.F的核外电子排布式1s22s22p7
B.Fe3+的轨道表示式![]() 违背了泡利不相容原理
违背了泡利不相容原理
C.N、As同主族,第一电离能N<As
D.电负性F>O>As
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.钠与水反应:Na+2H2O===Na++2OH-+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O ![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-===BaSO4↓+H2O
D.向澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-===CaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的D为无色黏稠液体,易溶于水,为研究D的组成与结构,进行了如下实验:
(1)称取D 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:D的相对分子质量为______。
(2)将此9.0 g D在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。则D的分子式为___________。
(3)另取D 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。实验结论:D中含有的官能团的名称是:_________、_________ 。
(4)D的核磁共振氢谱如下图:

实验结论:D的核磁共振氢谱中出现四组峰,即有不同化学环境的氢原子种数为4种,且峰面积之比为________。
(5)综上所述,D的结构简式______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com