
| A. | 10mol氧约含有6.02×1024个氧分子 | |
| B. | NA 约等于6.02×1023 | |
| C. | 摩尔是国际科学界广泛使用的一种物理量 | |
| D. | 摩尔是物质的量的单位,简称摩,符号为mol |
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:解答题
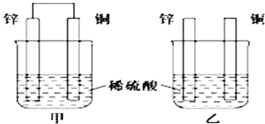
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石与盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| B. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| C. | 氢氧化铜溶于盐酸:Cu2++2OH-+2H+=Cu2++2H2O | |
| D. | 铁屑溶于稀硫酸溶液:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出原子学说 | B. | 提出分子学说 | ||
| C. | 发现元素周期律 | D. | 发现能量守恒定律 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+O2 $\frac{\underline{\;点燃\;}}{\;}$Na2O2 加热 | B. | HCl+NaOH=NaCl+H2O | ||
| C. | 2CaSO4 $\frac{\underline{\;加热\;}}{\;}$ 2CaO+2SO2↑+O2↑ | D. | Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH-)可能为0.01 mol/L | B. | c(OH-)可能为1×10-12mol/L | ||
| C. | 该溶液不可能是酸溶液 | D. | 该溶液可能是碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O+H2O═2NaOH | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | Na2CO3+2HCl═2NaCl+CO2↑+H2O | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 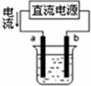 用如图装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 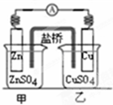 如图装置的盐桥中KCl的Cl-移向乙烧杯 | |
| C. |  如图装置中钢闸门应与外接电源的负极相连获得保护 | |
| D. | 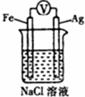 装置中滴入2滴黄色K3[Fe(CN)6]溶液,溶液中可能出现蓝色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com