
| 0.0041mol |
| 2 |
| 0.0492g |
| 0.2g |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| A、采用焚烧或深埋的方法处理垃圾 |
| B、推广使用太阳能、风能等新能源 |
| C、提高煤和石油的产量以满足社会对能源的需求 |
| D、将未经处理的工业废水直接排入江河湖泊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2:1 |
| B、2:1:1 |
| C、1:3:2 |
| D、1:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2 |
| B、H2S |
| C、SO3 |
| D、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH(aq) |
| △ |
| CO2 |
| O2/点燃 |
| H2O |
| NH3CO3 |
| △ |
| 石灰乳 |
| 燃烧 |
| Fe |
| Fe |
| A、①③④⑤ | B、②③④ |
| C、①②④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )
2006年6月5日是第35个世界环境日,我国环保总局确定的主题见图.下列措施不符合这一主题的是( )| A、用“绿色化学”工艺,使原料尽可能转化为所需的物质 |
| B、回收废电池,减少对环境的污染 |
| C、为使农作物高产,大量施用化肥和农药 |
| D、推广垃圾分类存放,分类回收,分类处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
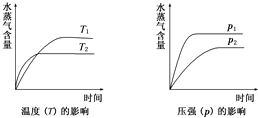
| A、2C6H5CH2CH3(g)+O2(g)?2C6H5CH=CH2(g)+2H2O(g)△H<0 |
| B、CO2(g)+H2(g)?CO(g)+H2O(g)△H>0 |
| C、CH3CH2OH(g)?CH2=CH2(g)+H2O(g)△H>0 |
| D、CO2(g)+2NH3(g)?CO(NH2)2(s)+H2O(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于6.7 | B、小于6.7 |
| C、等于6.7 | D、无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com