
| 族 周期 | IA | 0 | ||||||
| 1 | A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | B | C | D | |||||
| 3 | E | F | G | K | ||||

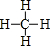 ,甲醇结构式为
,甲醇结构式为 ,
,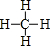 、
、 ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a>b |
| B、Q<0 |
| C、温度不变,压强增大,B的质量分数减少 |
| D、体积不变,温度升高,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c( H+)>c(OH-)的溶液一定显酸性 |
| B、常温下,pH=6 的溶液一定是酸溶液 |
| C、电解稀硫酸或氢氧化钠溶液的产物不同 |
| D、将纯水加热,其KW增大而pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中三个碳原子可能处于同一直线上 |
B、全氟丙烷的电子式为: |
| C、相同压强下,沸点:C3F8<C3H8 |
| D、全氟丙烷仅有一种结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③ | C、①④ | D、②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com