
| A. | 金刚石和C60 | B. | 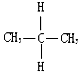 与 与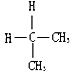 | ||
| C. | 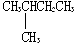 与 与 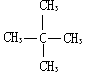 | D. | CH3CH3与CH3CH2CH2CH3 |
分析 结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物;互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物.
解答 解:A.金刚石和C60都是碳元素的单质,属于同素异形体,故A错误;
B.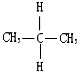 与
与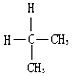 的结构相同,是同种物质,故B错误;
的结构相同,是同种物质,故B错误;
C.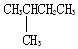 与
与 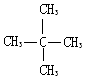 的分子式相同,但结构不同,属于同分异构体,故C错误;
的分子式相同,但结构不同,属于同分异构体,故C错误;
D.CH3CH3与CH3CH2CH2CH3的结构相似,在分子组成上相差2个CH2原子团,属于同系物,故D正确;
故选D.
点评 本题考查同系物的判断.互为同系物的物质满足以下特点:结构相似、化学性质相似、分子式通式相同、分子式不同、物理性质不同,研究对象是有机物,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,υ正(H2)=3υ逆(N2) | |
| B. | 保持容器压强不变时充入少量Ar气体,平衡不移动 | |
| C. | 升高温度,正向反应速率减小,逆向反应速率增加 | |
| D. | 该条件下,将1molN2和3molH2放在密闭容器中充分反应,放出92.4 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 石油裂解可以得到更多的汽油,这种汽油是一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,HNO2的电离平衡常数为K=4.6×10-4(已知$\sqrt{4.6}$=2.14),向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )
常温下,HNO2的电离平衡常数为K=4.6×10-4(已知$\sqrt{4.6}$=2.14),向20mL0.01mol•L-1的HNO2溶液中逐滴加入相同浓度的NaOH溶液,测得混合液的pH随NaOH溶液体积的变化如图所示,下列判断正确的是( )| A. | HNO2的电离方程式为HNO2=NO2-+H+ | |
| B. | a点H2O电离出的c(H+)=2.14×10-3mol•L-1 | |
| C. | b点溶液中离子浓度大小关系为c(NO2-)>c(Na+)>c(H+)>c(OH-) | |
| D. | X值等于20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
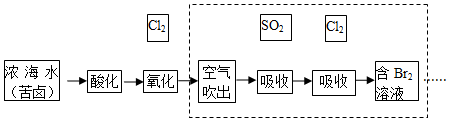
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能为 (b-a+5.6c)/4 kJ•mol-1 | |
| D. | 磷元素的非金属性比氯强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:PH3<NH3 | B. | 金属性强弱:Na>Mg>Al | ||
| C. | 酸性强弱:HF>HCl>HBr>HI | D. | 原子半径:K>Si>Cl>F |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com