
【题目】除去氯化钠中少量的氯化钙、硫酸钠杂质,下列选用的试剂及加入顺序正确的是
A. Na2CO3、BaCl2、HCl B. BaCl2、Na2CO3、H2SO4
C. BaCl2、Na2CO3、HCl D. Ba(NO3)2、Na2CO3、HCl
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
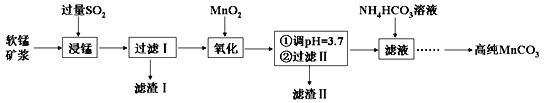
(1)过滤Ⅰ所得滤渣Ⅰ的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:__________________________。
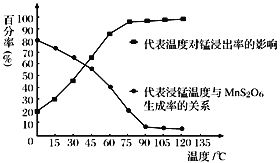
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少 MnS2O6 的生成,“浸锰”的适宜温度是_______。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度控制在30-35℃,温度不宜太高的原因是_______。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,充入气体X和气体Y反应生成气体Z,从反应开始到建立化学平衡,用X、Y、Z分别表示的化学反应速率为v(X)、v(Y)、v(Z)有以下关系:v(X)=3v(Y)、2v(Y)=v(Z),则此反应的化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验研究小组欲检验草酸晶体分解的产物并测定草酸溶液的浓度(杂质不发生反应)。查阅资料:草酸晶体(H2C2O4·2H2O)在100 ℃开始失水,101.5 ℃熔化,150 ℃左右分解产生H2O、CO和CO2。下面是可供选择的实验仪器(图中某些加热、夹持装置已略去),实验所需药品不限。
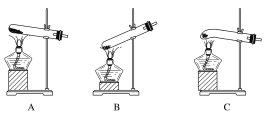
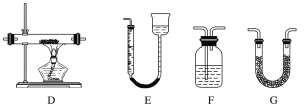
(1)最适宜加热分解草酸晶体的装置是C。若选装置A可能会造成的后果是______________;若选装置B可能会造成的后果是_________________________________。
(2)实验利用装置“G(碱石灰)—F—D(CuO固体)—F”检验CO,则F中盛装的试剂是_______,证明含有CO的现象是_____________________________________________。
(3)可用0.10 mol/L酸性KMnO4标准溶液来滴定未知浓度的草酸溶液。
①滴定过程中发生反成的离子方程式为_________________________________________。②滴定过程中操作滴定管的图示正确的是_________。
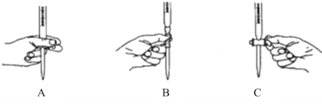
③判断反应达到滴定终点时的现象为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业上有许多用途。某工厂以辉铜矿(主要成分为 Cu2S,含少量 Fe2O3、SiO2 等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
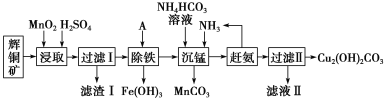
(1)“浸取”反应中氧化剂的化学式为________;若“浸取”反应中得到一种单质,则滤渣Ⅰ的成分为 MnO2 和________、________ (写化学式)。
(2)“除铁”这一步反应在 25 ℃ 进行,加入的试剂 A 为________,若加 A 后溶液 的 pH调为 4,溶液中 Fe3+浓度为______mol/L。{已知 Ksp[Fe(OH)3]=4.0×10-38}
(3)写出“沉锰”(除 Mn2+)过程中反应的离子方程式:________________________________。
(4)滤液Ⅱ经蒸发结晶得到的盐主要是__________(写化学式)。
(5)过滤Ⅱ的沉淀经过洗涤、干燥可以得到碱式碳酸铜,如何判断沉淀已洗净?_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用可溶性钡盐检验硫酸根离子的存在时,先在待测溶液中加入盐酸,其作用是
A. 形成较多的白色沉淀
B. 形成的沉淀纯度更高
C. 排除硫酸根离子以外其他阴离子及银离子的干扰
D. 排除钡离子以外的其他阳离子的干扰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列预测某些碱金属元素及其化合物的性质的结论错误的是( )
选项 | 已知某些碱金属元素及其单质的性质 | 预测某些碱金属元素及其单质的性质 |
A | 锂、钠、钾三种元素在自然界中都以化合态存在 | 铷元素和铯元素在自然界中都以化合态存在 |
B | 钾单质与空气中的氧气反应比钠单质更剧烈,甚至能燃烧 | 铷单质和铯单质比钾单质更容易与氧气反应,遇到空气就会立即燃烧 |
C | 钾单质与水反应比钠单质更剧烈,甚至爆炸 | 铷和铯比钾更容易与水反应,遇水立即燃烧,甚至爆炸 |
D | 锂元素和钠元素在化合物中的化合价都是 | 锂单质与氧气反应生成的氧化物有 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酒精厂由于管理不善,酒精滴漏到某种化学药品上而酿成火灾。该化学药品可能是( )
A. KMnO4 B. NaCl C. (NH4)2SO4 D. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I 用Cl2生产某些含氯有机物时会产生副产物HCl,利用反应A可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O。
2Cl2+2H2O。
已知:ⅰ反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.

(1)H2O的电子式是______________________。
(2)反应A的热化学方程式是_________________________________________________。
(3)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为________ kJ,H2O中H—O键比HCl中H—Cl键________(填“强”或“弱”)。
II 在一定条件下,可逆反应A2(g) + B2(g) ![]() 2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
2C(g)达到平衡时,各物质的平衡浓度c(A2)=0.5 mol·L-1、c(B2)=0.1 mol·L-1、c(C)=1.6 mol·L-1,若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
(1)a、b应满足的关系是________________________________;
(2)a的取值范围是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com