
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
分析 废液加入足量的AgNO3溶液,生成沉淀8.61g,沉淀为AgCl,根据n=$\frac{m}{M}$计算AgCl的物质的量,根据氯元素守恒计算溶液中n(Cl-),再根据c=$\frac{n}{V}$计算原废液中c(Cl-);废液放入铜片充分反应,铜片质量减少了0.256g,说明溶液中含有Fe3+,根据铜片减少的质量结合方程式计算溶液中Fe3+的物质的量,进而计算原废液中c(Fe 3+);由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe 3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),据此计算原废液中c(Fe2+)、c(Cu2+).
解答 解:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g,沉淀为AgCl,n(Cl-)=$\frac{8.61g}{143.5g/mol}$=0.06mol,c(Cl-)=6mol/L,阴离子只此一种,带负电荷量也是0.06mol,则没加含铜绝缘板时应含有Fe3+ 0.02mol(电荷守恒);
由(2)加含铜绝缘板后就会发生Cu+2Fe3+═Cu2++2Fe2+,Fe3+减少,Cu2+、Fe2+增加,但是正电荷的物质的量还是0.06mol,铜片质量减少了0.256g,即$\frac{0.256g}{64g/mol}$=0.004mol,令10mL废液中Fe3+为nmol,则:
2FeCl3 +Cu═2FeCl2+CuCl2
2 1
nmol 0.004
故n=0.008mol,所以原废液中c(Fe3+)=$\frac{0.008mol}{0.01L}$=0.8mol/L,
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe 3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),原废液中c(Cl-)=6mol/L,故3×0.8+2c(Fe2+)+2×$\frac{1}{2}$c(Fe2+)=6,解得c(Fe2+)=1.2mol/L,则c(Cu2+)=0.6mol/L,故原废液中c(Fe2+):c(Fe3+)=1.2mol/L:0.8mol/L=3:2,c(Fe3+):c(Cu2+)=0.8mol/L:0.6mol/L=4:3
A.由以上分析可知原废液中c(Fe2+):c(Fe3+)=3:2,故A错误;
B.由上述分析可知,c(Fe3+):c(Cu2+)=4:3,故B正确;
C.由上述分析可知,c(Cl-)=6mol/L,c(Fe2+)=1.2mol/L,故C错误;
D.该绝缘板腐蚀后减少的质量,即是参加反应的铜的质量,原废液中c(Cu2+)=0.6mol/L,但是原废液的总体积不知道,所以无法计算Cu的总物质的量和质量,故D错误;
故选B.
点评 本题考查化学反应方程式的计算,把握发生的化学反应及电荷守恒、原子守恒为解答的关键,侧重分析能力、计算能力的考查,题目难度较大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 残留固体是2mol Na2CO3 | |
| B. | 残留固体是 Na2CO3和NaOH的混合物 | |
| C. | 反应中转移2mol电子 | |
| D. | 排出的气体是1.5mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1的目的是检验装置的气密性 | |
| B. | 图2中分液漏斗振荡静置后,上层液体颜色变浅 | |
| C. | 图3中电流计的指针不发生偏转 | |
| D. | 图4液态水分解的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )
某一兴趣小组准备在实验室中制H2,装置如图所示.可是在实验室中发现酸液不足.为达到实验目的,则可以从长颈漏斗中加入下列试剂中的( )| A. | NaNO3溶液 | B. | 四氯化碳 | C. | 苯 | D. | Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
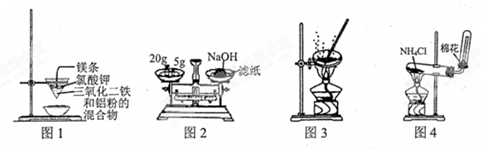
| A. | 用图1装置制取金属铁 | |
| B. | 用图2装置称量NaOH固体 | |
| C. | 用图3装置蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| D. | 用图4装置制取氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  (立方烷) (立方烷) | D. |  (环辛四烯) (环辛四烯) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
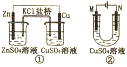
| A. | 装置中盐桥内的K+移向CuSO4溶液 | |
| B. | ①是将电能转变为化学能的装置 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置用于电解精炼钢,溶液中Cu2+的浓度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com