
【题目】完成下列化学方程式
(1)乙二醛与银氨溶液:___;
(2)苯酚钠溶液中通入少量CO2:___;
(3)足量乙酸与乙二醇发生酯化反应:___;
(4)乙醛与甲醇的加成反应:___。
【答案】OHC-CHO+4[Ag(NH3)2]OH→H4NOOC-COONH4+4Ag↓+6NH3+2H2O C6H5ONa +CO2+H2O→C6H5OH+NaCO3 2 +2H2O CH3CHO+CH3OH→CH3CH(OH)OCH3
+2H2O CH3CHO+CH3OH→CH3CH(OH)OCH3
【解析】
(1)醛类物质能与银氨溶液发生氧化反应;
(2)苯酚钠溶液中通入少量的CO2,根据强酸制弱酸原理书写方程式;
(3)羧酸与醇发生酯化反应,生成酯和水;
(4)乙醛结构中含有醛基,可发生加成反应;
(1)乙二醛能与银氨溶液发生氧化反应,生成乙二酸铵,银单质,氨和水,反应方程式为:OHC-CHO+4[Ag(NH3)2]OH→H4NOOC-COONH4+4Ag↓+6NH3+2H2O;
(2)苯酚钠溶液中通入少量的CO2,根据强酸制弱酸原理可知反应后生成苯酚和碳酸钠,反应方程式为:C6H5ONa +CO2+H2O→C6H5OH+NaCO3;
(3)乙酸与乙二醇发生酯化反应,生成二乙酸乙二酯和水,反应方程式为:2 +2H2O;
+2H2O;
(4)乙醛结构中含有醛基,可与甲醇发生加成反应,反应方程式为:CH3CHO+CH3OH→CH3CH(OH)OCH3。


科目:高中化学 来源: 题型:
【题目】1,3—二异丙烯基苯![]() 是重要的化工原料。下列有关1,3一二异丙烯基苯的说法正确的是
是重要的化工原料。下列有关1,3一二异丙烯基苯的说法正确的是
A.可以发生加成聚合反应B.不能使稀高锰酸钾溶液褪色
C.分子中所有原子共平面D.其苯环上的二氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育比赛中坚决反对运动员服用兴奋剂,倡导公平竞赛。某种兴奋剂的结构简式如图所示,下列有关该物质的说法中正确的是( )

A.遇FeCl3溶液显紫色,因为该物质属于苯酚的同系物
B.滴入KMnO4(H+)溶液,溶液的紫色褪去,能证明该物质分子中存在碳碳双键
C.该物质在一定条件下可以发生取代、加成、加聚、氧化、还原、消去等反应
D.1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H8O3的有机物,含苯环且苯环上有两个取代基,其中一个取代基为-OH与苯环直接相连,另一个取代基含![]() 结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )
结构基团,同时符合上述要求的所有同分异构体共有(不考虑立体异构)( )
A.6B.9C.12D.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光素因显亮绿色的荧光常用作吸附指示剂。它是用邻苯二甲酸酐和间苯二酚,在无水氯化锌作用下合成的,下列说法正确的是( )

A.上述三种有机物均属于芳香烃
B.邻苯二甲酸酐苯环上一氯代物共有4种
C.1mol间苯二酚与足量的浓溴水反应,最多消耗4molBr2
D.常温下1mol荧光素与足量NaOH溶液反应,最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛易溶于水,可以被新制的![]() 氧化,查阅文献得到如下资料:
氧化,查阅文献得到如下资料:
文献1:HCHO+Cu(OH)2![]() Cu+CO↑+2H2O;
Cu+CO↑+2H2O;
文献2:HCHO+4Cu(OH)2+2NaOH![]() 2Cu2O↓+Na2CO3+6H2O。
2Cu2O↓+Na2CO3+6H2O。
现用如图所示装置进行新制的![]() 氧化甲醛溶液的实验,并对部分产物进行检验。
氧化甲醛溶液的实验,并对部分产物进行检验。
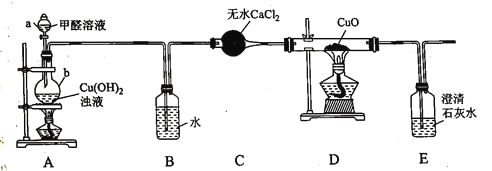
已知:Ⅰ![]() 中试剂为
中试剂为![]() 溶液和
溶液和![]() 溶液混合制成的浊液;
溶液混合制成的浊液;
Ⅱ![]() 甲醛溶液过量;
甲醛溶液过量;
Ⅲ![]() 红色
红色![]() 无色
无色![]() ;
;
Ⅳ![]() 蓝色
蓝色![]() 。
。
回答下列问题:
(1)仪器b的名称为__________;检查装置A的气密性的操作方法为______,装置B的作用为__________。
(2)实验开始后,应先点燃________![]() 填“A”或“D”
填“A”或“D”![]() 处酒精灯;装置A加热时温度不宜过高,否则可能产生的不良后果是___________
处酒精灯;装置A加热时温度不宜过高,否则可能产生的不良后果是___________![]() 任写一种
任写一种![]() 。
。
(3)证明产物中含有CO的实验现象为_____;上述装置的设计中存在的缺陷为_______。
(4)取装置A中生成的红色固体于试管中,进行如下实验:
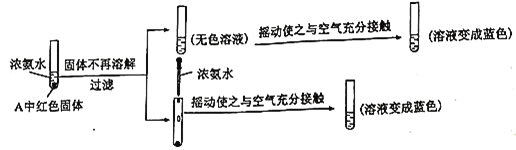
①能证明红色固体中含有![]() 的实验现象为______________。
的实验现象为______________。
②过滤后的红色固体与浓氨水在空气中充分摇动后,发生反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )
的原子序数之和为20。甲、乙分别为元素E、A的单质, 丙、丁为A、E分别与B形成的二元化合物,它们转化关系如图所示。下列说法不正确的是( )

A.![]() 、
、![]() 形成的一种化合物具有漂白性
形成的一种化合物具有漂白性
B.![]() 、
、![]() 形成的离子化合物可能含有非极性键
形成的离子化合物可能含有非极性键
C.![]() 的单质能与丙反应置换出
的单质能与丙反应置换出![]() 的单质
的单质
D.丁为黑色固体,且1mol甲与足量丙反应转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知T、X、Y、Z是中学化学常见的四种元素,其结构或性质信息如下表:
元素 | 结构或性质信息 |
T | 原子的L层上s电子数等于p电子数 |
X | 元素的原子半径是第三周期主族元素中最大的 |
Y | 空气中含其单质,原子的最外层未成对电子数是该元素所在周期中最多的 |
Z | 单质常温、常压下是气体.原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题:
(1)写出与Y2互为等电子体的分子式______________;
(2)在相同状况下,Y的简单氢化物的沸点高于Z的氢化物,其原因是______________;
(3)T、X、Y三种元素的电负性由大到小的顺序(填元素符号)是______________;
(4)元素Q的原子序数是X与Z的原子序数之和.
①该元素基态原子的最外层电子排布式为______________;
②元素Q与元素T、Y、Z分别形成平面型的[Q(TY)4]2-和四面体的[QZ4]2-,其中T与Y、Q与Z成键时中心原子采用的杂化方式分别是_________、___________;
③元素Q形成的单质的晶体结构如下图所示,该晶体形成时的原子堆积方式是__________(选填“甲”、“乙”、“丙”)。
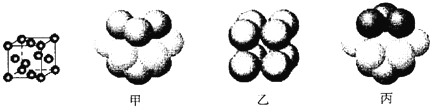
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com