
| 离子 | K+ | Na+ | NH4+ | SO32- | NO3- | Cl- |
| 浓度/mol•L-1 | 7×10-6 | 3×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |


| 时间(min) 浓度(mol/L-1) | 0min | 10min | 20min | 30min | 40min | 50min |
| NO(mol/L-1) | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2(mol/L-1) | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
分析 Ⅰ.(1)依据电荷守恒,结合表中数据,负电荷总数多于正电荷,所以溶液中还应有氢离子,亚硫酸根离子与氢离子不能大量共存,依据电荷守恒,可计算出溶液中氢离子浓度,再计算pH值即可;
Ⅱ.(2)二氧化硫是酸性氧化物,能和强碱之间发生反应;
(3)1molCe3+再生转化为Ce4+,提供电子为1mol,1mol甲烷完全燃烧,转移电子为mol,据此解答即可;
(4)根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)•c(SO32-)进行计算;
(5)温度越高,对设备的要求越高,所以如果催化剂在较低温度下能较大程度的脱氢即可;根据纵坐标判断,相同温度下,脱氢率越高的效果越好;
(6)根据生成11.2L N2(标)即0.5mol反应放出的热量为QkJ,则生成2mol氮气放出4QkJ热量,据此书写热化学方程式;
(7)Tl℃时,由表格数据可知20min达到平衡,平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,以此计算反应的平衡常数;
(8)30min后,只改变某一条件,反应重新达到平衡,1/2C(s)+NO(g)═1/2N2(g)+1/2CO2(g),由图表数据分析,平衡状态物质浓度增大,平衡常数K′═$\frac{\sqrt{0.36×0.36}}{0.48}$=0.75,平衡常数不变,则结合浓度增大的影响因素来解答.
解答 解:Ⅰ、(1)根据表中数据,负电荷总数多于正电荷,根据溶液中遵循电荷守恒:c(K+)+c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-),即:3×10-6+7×10-6+3×10-5+c(H+)=2×3×10-5+5×10-5+2×10-5,解c(H+)=10-4mol•L-1,pH值为4,溶液呈酸性,而亚硫酸根离子与氢离子不能大量共存,故表中用亚硫酸根离子表示浓度有错,应用亚硫酸氢根离子表示,
故答案为:4;表中用亚硫酸根离子表示浓度有错,应用亚硫酸氢根离子表示;
Ⅱ.(2)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,
故答案为:SO2+OH-=HSO3-;
(3)1molCe3+再生转化为Ce4+,提供电子为1mol,甲烷燃料电池中,在碱性溶液中,甲烷燃料电池的负极反应式为CH4-8e-+10OH-═CO32-+7H2O,消耗24g甲烷时,转移电子数为12mol,每生成1molCe4+,提供电子为1mol,所以当消耗24g甲烷时,理论上可再生12mol Ce4+.,
故答案为:12;
(4)根据硫酸钙的溶度积常数表达式Ksp(CaSO3)=c(Ca2+)•c(SO32-)可知,c(SO32-)=$\frac{Ksp(CaSO{\;}_{3})}{c(Ca{\;}^{2+})}$=$\frac{1.4×10{\;}^{-7}}{0.7}$mol/L=2.0×10-7mol/L,
故答案为:2.0×10-7mol/L.
(5)根据图乙知Mn催化剂时,在200℃左右脱氮率最高,Cr作催化剂,500℃左右脱氮率最高,但二者的最高脱氮率差不多,使用Mn作催化剂需要的温度低,更经济,因此使用的最佳的催化剂和相应的温度分别为Mn、200℃左右,
故答案为:Mn、200℃左右;
(6)脱氮效果最佳时c(NO2):c(NO)=1:1,生成11.2L N2(标)即0.5mol反应放出的热量为QkJ,则生成2mol氮气放出4QkJ热量,因此反应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2 (g)+3H2O(g)△H=-4Q kJ•mol-1,
故答案为:2NH3(g)+NO(g)+NO2(g)=2N2 (g)+3H2O(g)△H=-4Q kJ•mol-1;
(7)Tl℃时,由表格数据可知20min达到平衡,平衡浓度c(N2)=0.3mol/L、c(CO2)=0.3mol/L、c(NO)=0.4mol/L,根据反应1/2C(s)+NO(g)═1/2N2(g)+1/2CO2(g),则K=$\frac{\sqrt{0.3×0.3}}{0.4}$=0.75,
故答案为:0.75;
(8)30min后,只改变某一条件,反应重新达到平衡,C(s)+2NO(g)?N2(g)+CO2(g),由图表数据分析,平衡状态物质浓度增大,平衡常数K′═$\frac{\sqrt{0.36×0.36}}{0.48}$=0.75,平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;由氮气浓度增大,二氧化碳和一氧化氮浓度增大,反应前后气体体积不变,则改变的条件可能是通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2,
故答案为:通入一定量的NO或适当缩小容器的体积或增大压强或通入等物质的量的CO2和N2.
点评 本题考查较综合,涉及氧化还原反应、化学平衡计算、原电池等,侧重化学反应原理的综合应用能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③ | C. | ④ | D. | 均不符合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将浓度为0.1 mol•L-1 HF溶液加水不断稀释过程中,K(HF)保持不变 | |
| B. | 等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生 | |
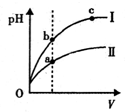
| D. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.5L | B. | 9.0L | C. | 16.8L | D. | 15.7L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫元素在自然界中既有游离态,又有化合态 | |
| B. | 浓硫酸不可用来干燥H2S气体,因其具有强氧化性 | |
| C. | 硫单质与铁反应生成硫化铁 | |
| D. | SO2、SO3都为酸性氧化物,都可与水反应生成相应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们可以位于同一周期 | |
| B. | 它们可以是同种元素的不同核素的离子 | |
| C. | 一定有a<b<c<d | |
| D. | 离子半径的大小关系为X m+<Y n+<Z n-<Rm- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com