
【题目】实验室常用澄清石灰水检验CO2 , 已知在20℃时,每100g水溶解Ca(OH)20.165g即达到饱和.
(1)在20℃500g水中加入37.0g Ca(OH)2粉末,经充分搅拌,若液体体积仍为500mL,求OH﹣离子的物质的量浓度.
(2)若使原500mL溶液中的c(Ca2+)降低至0.01mol/L,求需要通入标准状况下二氧化碳气体多少升?
【答案】
(1)解:在20℃时,500g水中加入37.0g Ca(OH)2粉末,溶解的氢氧化钙的质量为0.165g× ![]() =0.825g,则所得饱和溶液的物质的量浓度c=
=0.825g,则所得饱和溶液的物质的量浓度c= ![]() =
= ![]() mol/L=0.022mol/L,c(OH﹣)=2×0.022mol/L=0.044mol/L.
mol/L=0.022mol/L,c(OH﹣)=2×0.022mol/L=0.044mol/L.
答:OH﹣离子的物质的量浓度为0.044mol/L
(2)解:使原500mL溶液中的c(Ca2+)降低至0.01molL﹣1,反应的钙离子物质的量为:0.5L×(0.022﹣0.01)molL﹣1=0.006mol,设反应的二氧化碳的物质的量为x,则:
CO2+ | Ca 2++ | 2OH﹣ | =CaCO3↓+H2O |
1 | 1 | ||
x | 0.006mol |
因此x=0.006mol,通入标准状况下二氧化碳气体V=nVm=0.006mol×22.4L/mol=0.134L.答:需要通入标准状况下二氧化碳气体0.134L
【解析】(1)根据氢氧化钙的溶解度可知,在20℃时,500g水中加入37.0g Ca(OH)2粉末溶解的氢氧化钙的质量,然后带入n= ![]() 、c=nV计算;(2)计算出反应掉的钙离子的物质的量,然后根据化学方程式进行求算.
、c=nV计算;(2)计算出反应掉的钙离子的物质的量,然后根据化学方程式进行求算.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案: 
如果此方案正确,那么:
(1)操作①可选择的仪器是 .
(2)操作②是否可改为加硝酸钡溶液?为什么?;理由 .
(3)进行操作②后,如何判断SO ![]() 已除尽,方法是 .
已除尽,方法是 .
(4)操作③的目的是 . 为什么不先过滤后加碳酸钠溶液?理由是 .
(5)操作④的目的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应.求:
(1)6.50g锌的物质的量;
(2)所用盐酸中HCl的物质的量浓度;
(3)反应中生成的在标准状况下H2的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36 g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2SO4;冷却至室温,搅拌下加入24 g NaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。

(1)仪器A的名称是_____________;加入搅拌磁子的目的是防止暴沸和___________________。
(2)反应时生成的主要有机副产物有2-溴丙烷和__________________________________。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是___________________。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是______________________________。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作: 向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________,静置,分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为3L的密闭容器中,A、B、C三种气态物质的物质的量随时间变化曲线如图所示。请回答以下问题:
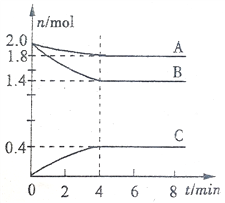
(1)该反应的化学方程式是_________________________________。
(2)反应从开始到平衡时,气体B的平均反应速率是___________________。
(3)该反应的化学平衡常数表达式是______________________________。
(4)其他条件不变,升高温度,逆反应速率将____________(填“加快”、“减慢”或“不变”)。
(5)反应达平衡后,其他条件不变,增加容器体积,平衡将__________(填“正向移动”、“逆向移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 在潮湿的空气中,马口铁和白铁皮镀层受损后,铁都比受损前更容易生锈
B. CaCO3(s) = CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的ΔH<0
C. 反应N2(g)+3H2(g)![]() 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大
D. 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零):H2(g) +Cl2(g) = 2HCl(g) △H1= -Q1 kJ·mol-1 H2(g) +Br2(g) = 2HBr(g) △H2= -Q2 kJ·mol-1 则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A. 在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B. 对2H2O2![]() 2H2O+O2的反应,使用MnO2可加快制O2的反应速率
2H2O+O2的反应,使用MnO2可加快制O2的反应速率
C. 反应CO+NO2![]() CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度使平衡向逆反应方向移动
D. 合成氨反应:N2+3H2![]() 2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
2NH3 ΔH<0,为使氨的产率提高,应采取低温高压的措施
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com