
在某一容积为 V L的密闭容器内,加入等物质的量的X和Y,在一定的条件下发生如下反应:X(g)+Y(g) 2Z(g) ΔH<0
2Z(g) ΔH<0
(1)该反应的化学平衡常数表达式为______________。
(2)若升高温度,化学反应速率________,Z的浓度________,化学平衡常数K________(均填“增大”、“减小”或“不变”)。
(3)下图中Ⅰ、Ⅱ表示该反应在t1时达到平衡,在t2时因改变某个条件而发生变化的曲线:
由图Ⅰ判断,反应进行至t2 min时,曲线发生变化的原因是 (用文字表示);
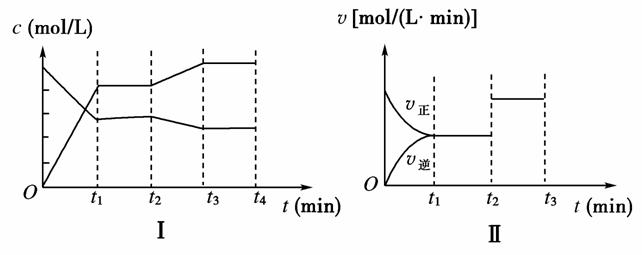
由图Ⅱ判断,t2 min到t3 min的曲线变化的原因可能是________(填字母)。
a.降低温度 b.加了催化剂 c.增加Z的量 d.缩小容器体积
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果化学计量数是1,不再填写):
 (2)整个过程中的还原剂是________。
(2)整个过程中的还原剂是________。
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4 层的颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____________________________________________________________。
(4)加碘盐中含碘量为20 mg·kg-1~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________ L(标准状况,保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是(双选)( )
A.39 g苯分子中含有的碳碳双键数为1.5NA
B.1 mol CH3COONa和少量CH3COOH溶于水所得中性溶液中,CH3COO-数目为NA
C.电解精炼铜的过程中,电路中每通过NA个电子,阳极溶解铜32 g
D.5.6 g Fe投入足量稀硫酸中,充分反应,转移电子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有NH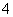 、Fe2+、SO
、Fe2+、SO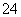 与H2O,下列实验叙述中不正确的是( )
与H2O,下列实验叙述中不正确的是( )
A.取少量硫酸亚铁铵晶体于试管中,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水
B.取少量硫酸亚铁铵晶体溶于水,得到浅绿色溶液,滴入2滴KSCN溶液,溶液不显血红色,再滴入几滴新制氯水,溶液变为血红色,则可证明晶体的成分中含有Fe2+
C.取少量硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO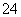
D.取少量硫酸亚铁铵晶体溶于水,加入少量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明晶体的成分中含有NH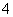
查看答案和解析>>
科目:高中化学 来源: 题型:
在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:
2A(g) + B(g) 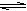 2C(g)达平衡时,在相同条件下测得容器内混合气体的压强是反应前的
2C(g)达平衡时,在相同条件下测得容器内混合气体的压强是反应前的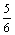 ,则A 的转化率为( )
,则A 的转化率为( )
A.67% B.50% C.25% D.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
NO2溶于水生成硝酸的反应为:3NO2(g)+H2O(1)  2HNO3(1)+NO(g) △H<0。为了提高硝酸的产率,工业生产中常采取的措施是 ( )
2HNO3(1)+NO(g) △H<0。为了提高硝酸的产率,工业生产中常采取的措施是 ( )
A.升温 B.加水 C.通往过量的氧气 D.减压
查看答案和解析>>
科目:高中化学 来源: 题型:
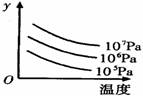
有某可逆反应aA(g)+bB(g)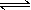 cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
cC(g);右图表示外界条件(温度、压强)的变化对上述反应的影响。下列判断正确的是( )
A.a+b<c时,y轴表示平衡混合气中C的质量分数
B.a+b<c时,y轴表示平衡混合气的平均摩尔质量
C.△H>0时,y轴表示达到平衡时B的转化率
D.△H<0时,y轴表示达到平衡时A的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.石墨烯[如图(甲)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(乙)所示]。
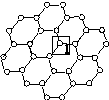
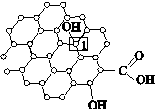
(甲)石墨烯结构 (乙)氧化石墨烯结构 (丙)
(1)图(甲)中,1号C与相邻C形成σ键的个数为________。
(2)图(乙)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(甲)中1号C与相邻C形成的键角。
(3)若将图(乙)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
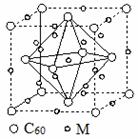
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图(丙)所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
Ⅱ.ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(5) H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
 ①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: 。
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因: 。
②H2SeO4比H2SeO3酸性强的原因: 。
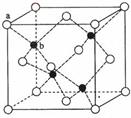
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如右图所示,其晶胞边长为540.0pm,其密度为
g/cm3(列式并计算),a位置S2-与b位置Zn2+之间的距离为 pm(列式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com