
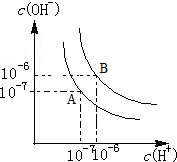
 水的电离平衡如图所示.
水的电离平衡如图所示.分析 (1)Kw=C(H+).C(OH-),图象分析可知c(H+)=c(OH-)=10-6mol/L,
(2)先根据水的离子积常数计算氢氧化钡溶液中C(OH-)、混合溶液中C(OH-),再根据$\frac{c(O{H}^{-})V(Ba(OH)_{2})-c({H}^{+})V(HCl)}{V(Ba(OH)_{2})+V(HCl)}$计算氢氧化钡和盐酸的体积之比.
解答 解:(1)25℃时纯水中C(H+)=C(OH-)=10-7 mol/L,Kw=C(H+).C(OH-)=10-14 ,当温度升高到100℃,纯水中C(H+)=C(OH-)=10-6 mol/L,Kw=C(H+).C(OH-)=10-12 ,故答案为:1×10-12;
(2)将pH=8的Ba(OH)2溶液中C(OH-)=10-4 mol/L,pH=5的稀盐酸中C(H+)=10-5 mol/L,设氢氧化钡的体积为x,盐酸的体积为y,混合溶液的pH=7,溶液呈碱性,C(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=10-5 mol/L,C(OH-)=$\frac{1{0}^{-4}x-1{0}^{-5}y}{x+y}$=10-5 mol/L,x:y=2:9,
故答案为:2:9.
点评 本题考查了离子积常数的有关计算,注意混合溶液的pH=7时溶液呈碱性而不是中性,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
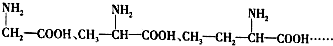
 ,B
,B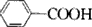 ,CCH2(NH2)COOH.
,CCH2(NH2)COOH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=11的溶液中,K+、Cl-、HSO3-、Na+可以大量共存 | |
| B. | 在pH=0的溶液中,Na+、NO3-、Fe2+、K+可以大量共存 | |
| C. | 常温下,由0.1 mol•L-1一元碱BOH溶液的pH=10,可知BOH溶液中存在BOH?B++OH- | |
| D. | 常温下,由0.1 mol•L-1一元酸HA溶液的pH=3,可推知NaA溶液中存在A-+H2O=HA+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
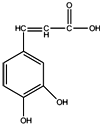
| A. | 1mol该有机物分别与足量的Na、NaOH、Na2CO3反应,消耗它们的物质的量之比为3:3:1 | |
| B. | 所有碳原子可能共平面 | |
| C. | 与溴水既能发生取代反应又能发生加成反应 | |
| D. | 能与新制的Cu(OH)2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol/L | B. | 1 mol/L | C. | 3 mol/L | D. | 4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子序数:X<Y<Z | B. | 气态氢化物稳定性:XH3<YH3<ZH3 | ||
| C. | 元素的非金属性强弱:X>Y>Z | D. | 电子层数:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7gH2O2中含有的电子总数为0.9NA | |
| B. | 92g NO2和N2O4的混合气中含有的氮原子数为2NA | |
| C. | 标准状况下,28 g CO与22.4 L O2所含原子数相等 | |
| D. | 1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com