
向某晶体中加入含Fe2+的溶液后,无明显变化,当滴加几滴新制氯水时,混合液变成血红色,则下列结论中错误的是
A.该晶体中一定含有SCN— B.氧化性:Fe3+ > Cl2
C.Fe2+与SCN—不能形成红色物质 D.Fe2+被氯水氧化成Fe3+
科目:高中化学 来源: 题型:阅读理解
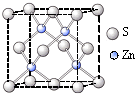
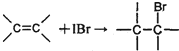
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
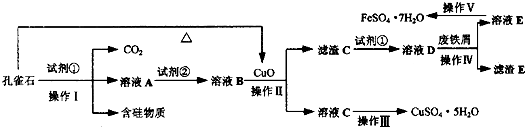
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 6.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
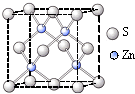
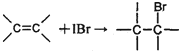
查看答案和解析>>
科目:高中化学 来源:2011年江苏省宿迁市泗阳县致远中学高考化学模拟试卷(解析版) 题型:解答题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com